
 ×金属质量,计算生成0.4g氢气消耗选项所涉及金属铁、锌、镁、铝、钠的质量;然后根据题设的条件:两种金属混合物6.8g,与足量稀硫酸反应后生成了0.4 g氢气,推断出两种金属混合物的可能组成.
×金属质量,计算生成0.4g氢气消耗选项所涉及金属铁、锌、镁、铝、钠的质量;然后根据题设的条件:两种金属混合物6.8g,与足量稀硫酸反应后生成了0.4 g氢气,推断出两种金属混合物的可能组成. =11.2g;需要金属锌的质量0.2g×
=11.2g;需要金属锌的质量0.2g×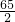 =13g;需要金属镁的质量=0.4g×
=13g;需要金属镁的质量=0.4g×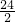 =4.8g;需要金属铝的质量=0.4g×
=4.8g;需要金属铝的质量=0.4g× =3.6g;需要金属钠的质量=0.4g×
=3.6g;需要金属钠的质量=0.4g× =9.2g,铜不与稀硫酸反应;根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物6.8g与足量稀硫酸反应后生成了0.4g氢气,可判断选项混合物中两种金属只可能为金属铜与铝的混合物或镁和锌的混合物;
=9.2g,铜不与稀硫酸反应;根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物6.8g与足量稀硫酸反应后生成了0.4g氢气,可判断选项混合物中两种金属只可能为金属铜与铝的混合物或镁和锌的混合物; ×金属质量,利用该公式进行计算时,需要注意到铁在与酸发生置换反应时呈现出+2价.
×金属质量,利用该公式进行计算时,需要注意到铁在与酸发生置换反应时呈现出+2价. 

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:
 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.查看答案和解析>>
科目:初中化学 来源:不详 题型:多选题
| A.Al Mg | B.Na Fe | C.Al Cu | D.Mg Zn |
查看答案和解析>>
科目:初中化学 来源:初中化学竞赛讲座第2讲—平均值法(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com