
甲同学在用双氧水制取氧气时,误把Fe2O3粉末当成MnO2放入双氧水中,发现也有大量气泡产生。他意识到这个错误后,联想到MnO2可作为H2O2分解的催化剂,那么Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能作为H2O2分解的催化剂。
【实验验证】甲同学依次设计了三个实验:
实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二:在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明_____________________________________。
实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g。说明____________________________________________。
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。写出该反应的文字表达式____________________________________________。
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。该实验是__________________________________。
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据的分析,你能得出的结论是_______________________________________________,
用足量等体积H2O2溶液制取相同体积O2所需的时间:
|
时间(min) 催化剂 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| 加入W g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入W g Fe2O3 | 7.0 | 9.0 | 16.0 |
解析:根据催化剂的特征“一变二不变”,具有能改变反应速率,而本身的质量和化学性质在反应前后都不改变的物质才能作催化剂。
答案:实验二:Fe2O3能加快H2O2的分解速率
实验三:反应前后Fe2O3的质量保持不变
【实验结论】过氧化氢 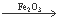 水 + 氧气 (催化剂写成MnO2不得分)
水 + 氧气 (催化剂写成MnO2不得分)
【反思评价】反应前后Fe2O3的化学性质是否改变(或反应前后Fe2O3是否转化为其它物质)
【拓展】相同条件下,MnO2的催化效果比Fe2O3好(或其它条件相同的情况下,H2O2浓度越大,产生氧气的速率越快).
【分析】
(1)过氧化氢 水 + 氧气
水 + 氧气
H2O2 H2O + O2
H2O + O2
(2)氯酸钾 氯化钾+氧气
氯化钾+氧气
KClO3 KCl+O2
KCl+O2
(3)高锰酸钾 锰酸钾 + 二氧化锰+ 氧气
锰酸钾 + 二氧化锰+ 氧气
KMnO4 K2MnO4 + MnO2+ O2
K2MnO4 + MnO2+ O2


科目:初中化学 来源: 题型:阅读理解
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2g | 无其它物质 | |
| ⑤ | 1.2g | CuO0.5g | |
| ⑥ | 1.2g | MnO20.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
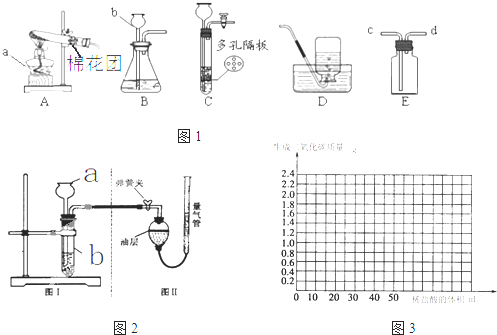
| ||
| ||
| ||
| ||
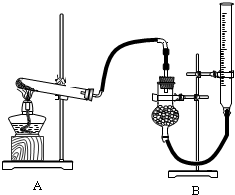
| 甲 | 乙 | |
| 实验过程 |  |
 |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. |
|
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为 CaCO3+2HCl═2CaCl2+H2O+CO2↑ CaCO3+2HCl═2CaCl2+H2O+CO2↑ Ⅱ对比甲同学实验①②可知, 盐酸越浓(溶质的质量分数越大) 盐酸越浓(溶质的质量分数越大) ,化学反应的速度越快;Ⅲ对比甲同学实验 ②③ ②③ (填实验序号)可知,反应物的接触面积越大,反应速率越快 快 .Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是 时间 时间 和锥形瓶及药品的质量或二氧化碳的质量 锥形瓶及药品的质量或二氧化碳的质量 . | |
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |


查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
甲同学在用双氧水制取氧气时,误把Fe2O3粉末当成MnO2放入双氧水中,发现也有大量气泡产生。他意识到这个错误后,联想到MnO2可作为H2O2分解的催化剂,那么Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能作为H2O2分解的催化剂。
【实验验证】甲同学依次设计了三个实验:
实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃。说明H2O2溶液常温下缓慢分解。
实验二:在实验一的试管中加入W g Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃。说明_____________________________________。
实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g。说明____________________________________________。
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。写出该反应的文字表达式____________________________________________。
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验。该实验是__________________________________。
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据的分析,你能得出的结论是_______________________________________________,
用足量等体积H2O2溶液制取相同体积O2所需的时间:
|
时间(min) 催化剂 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| 加入W g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入W g Fe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com