
| A. | S在氧气中燃烧会产生大量白烟 | |
| B. | Fe在氧气中燃烧反应生成Fe2O3 | |
| C. | Fe在氧气中燃烧是吸热反应 | |
| D. | S、Fe与氧气反应均体现了氧气的氧化性 |
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
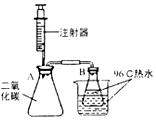 学习小组用如图裝置探究二氧化碳与氢氧化钠的反应.
学习小组用如图裝置探究二氧化碳与氢氧化钠的反应.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| Cu-Zn合金的质量/g | 稀硫酸的质量/g | 反应后烧杯内物质的总质量/g |
| 4.0 | 10 | 13.96 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
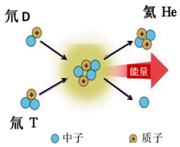 中科院的“人造太阳”EAST物理实验获重大突破,实验中首次实现持续时间达102秒的超高温长脉冲等离子体放电,为目前世界最长,其原理如图.
中科院的“人造太阳”EAST物理实验获重大突破,实验中首次实现持续时间达102秒的超高温长脉冲等离子体放电,为目前世界最长,其原理如图. 
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
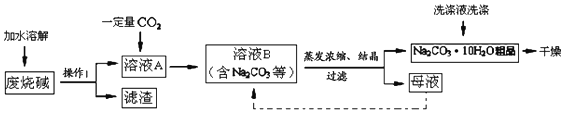
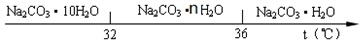
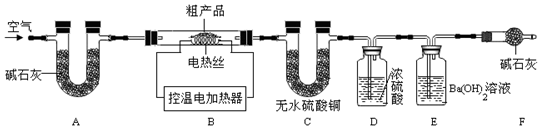
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com