
【题目】如图所示,烧杯中盛有一定量硫酸溶液,闭合开关后。
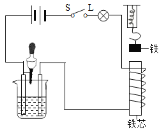
(1)图中电磁铁的上端为_____极。
(2)逐滴往烧杯中加入氢氧化钡溶液至过量,灵敏弹簧测力计的示数变化情况为_____。
(3)写出发生反应的化学方程式_____。
【答案】S 先变小后变大 H2SO4+Ba(OH)2=BaSO4↓+2H2O
【解析】
(1)由图可见,螺线管中电流由上端流入,右手握住导线,四指指向电流方向,大拇指指向下方,即电磁铁的下端为N极,上端为S极;
(2)随着氢氧化钡的滴加,硫酸减少,而生成的水不导电,硫酸钡是不溶于水的沉淀,溶液的导电性变弱电流变小,电磁铁磁性减弱,弹簧秤示数变小.直至两物质恰好反应,再滴加氢氧化钡时,这是溶液中增加了自由的氢氧根离子和钡离子,导致溶液的导电性又在不断变强,情况与开始的过程正好相反。故弹簧测力计的示数变化为先变小后变大;
(3)该反应的化学方程式为:H2SO4+Ba(OH)2=BaSO4↓+2H2O。


科目:初中化学 来源: 题型:
【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】推理是一种重要的思维方法,以下推理合理的是( )
A. 酸中一定含有氢元素,所以含有氢元素的物质一定是酸
B. 置换反应有单质生成,所以有单质生成的反应一定是置换反应
C. 中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
D. 化学反应伴随能量变化,所以金属腐蚀过程中一定伴随能量变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是四种粒子的结构示意图,下列说法正确的是( )

A.②③属于同种元素 B.②④的化学性质相同
C.②的符号为Al+3 D.①③形成的化合物是MgF2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组根据如图装置进行实验室制取气体的探究,请回答。
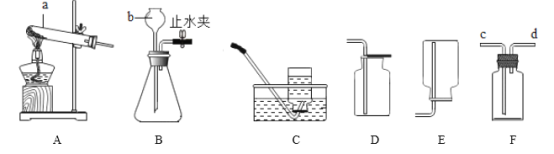
(1)写出指定仪器的名称:b______。
(2)实验室若用B装置制取氧气,发生反应的化学方程式为______。若某同学用C装置收集一瓶较纯净氧气,当观察到______时开始收集。若选装置D用向上排空气法收集氧气,验满方法为_______。若装置F内装满水收集氧气时,还可用于测定产生氧气的体积,此时还需要______(填仪器名称),氧气由导管______(填“c”或“d”)进入F中。
(3)实验室常用无水醋酸钠固体和碱石灰固体共热制得甲烷气体,已知甲烷密度比空气小、难溶于水。应该选择的制取装置为_______(填字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在点燃条件下,A和B反应生成C和D。反应前后分子种类变化的微观示意图如下所示。请回答以下问题:

(1)四种物质中,属于氧化物的是____________(填图中字母)。
(2)该反应____________(填“属于”或“不属于’)化合反应。
(3)物质A的化学式为____________,其中氮元素的化合价为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。计算:
(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%);
(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各组物质的溶液,不用其他试剂,不能将它们一一鉴别出来的是( )
A.Ba(OH)2 NaCl Na2SO4 Na2CO3
B.NaOH Ca(OH)2 HNO3 Na2CO3
C.BaCl2 NaCl NaOH CuSO4
D.HCl CaCl2 AgNO3 Na2CO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
(物质制备)利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式:
FexOy+yH2![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2![]() 3Fe+CH4
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式____________.
(2)焙烧中加入焦炭的作用:______、_________。
(含量测定)为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知 3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe (假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).
3CO2+6H2O+8Fe (假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).
(3)主要实验步骤如下:

①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①→ _____ →______ →______→_______ → _______ →⑦(填字母);
步骤②和③能否交换?_____(填“能”或“不能”)原因是______
(4)步骤⑤和⑥能否交换?_______(填“能”或“不能”)原因是_______
(5)装置F的作用是____________,若缺少装置F,则所测氧元素质量分数将______ (选填“偏大”、“偏小”或“不变”下同),碳元素的质量分数将 _______
(6)粗还原铁粉样品的质量为5.0g,装置B,E分别增重0.54g和0.44g.则样品中氧元素质量分数为____和碳元素的质量分数为________(要求计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com