解:(1)大理石和稀盐酸反应生成水、氯化钙和二氧化碳,化学方程式是CaCO
3+2HCl=CaCl
2+CO
2↑+H
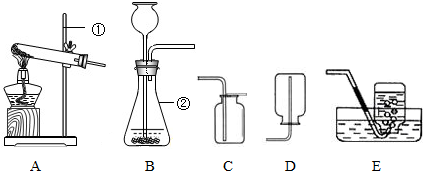
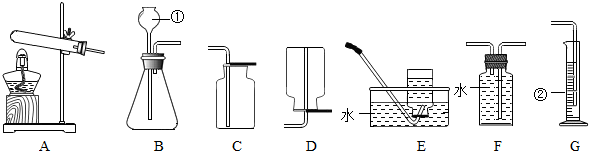
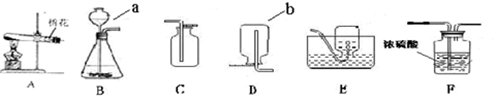
2O;用大理石和稀盐酸制取二氧化碳属于“固液常温型”,所以选择发生装置B,要收集一瓶干燥的二氧化碳,可将气体通过浓硫酸进行干燥,二氧化碳的密度比空气大且能溶于水,所以只能用向上排空气法收集;
故答案为:CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;BCF;
(2)装置A是用加热固体的方法制取气体,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气;高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气;
故答案为:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(3)锌和硫酸反应生成硫酸锌和氢气;
故答案为:Zn+H
2SO
4═ZnSO
4+H
2↑;
(4)过氧化钠(Na
2O
2)固体和水在常温下反应能生成氧气和氢氧化钠,方程式是2Na
2O
2+2H
2O═4NaOH+O
2↑;该反应不需要加热,故选发生装置B;
故答案为:B;2Na
2O
2+2H
2O═4NaOH+O
2↑.
分析:根据反应物、生成物及反应条件和方程式的书写方法书写方程式,并依据实验目的和装置作用选择相应的装置,选择发生装置依据反应物的状态和反应条件,选择收集装置考虑气体的密度和溶解性.
点评:本题着重考查了对装置选取方法的掌握和应用,以及书写方程式的能力,因此掌握选择装置的方法和方程式的书写方法(一写二配三注四等)是解答的关键.


 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;