
分析 根据无水硫酸铜溶于水变成蓝色,碳酸钠和氯化钙会生成碳酸钙沉淀,碳酸钠和盐酸会生成二氧化碳气体等知识进行分析.
解答 解:根据“将该白色粉末溶于水,得到无色溶液”,而无水硫酸铜溶于水变成蓝色,碳酸钠和氯化钙会生成碳酸钙沉淀,碳酸钠和盐酸会生成二氧化碳气体.
(1)将该白色粉末溶于水,得到无色溶液,而无水硫酸铜溶于水变成蓝色,说明一定不存在 CuSO4.
(2)取上述所得无色透明溶液于另一试管中,向其中加入足量的稀盐酸,碳酸钠和盐酸反应会生成二氧化碳气体,所以观察到有气泡产生的现象,得出结论,白色粉末中一定含有Na2CO3,推出一定不含CaCl2,碳酸钠和氯化钙反应会生成碳酸钙沉淀和氯化钠,化学方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)将(2)所得溶液蒸发只得到NaCl一种物质,则原白色粉末 不一定含有NaCl.理由是 步骤(2)中稀HCl与Na2CO3也会反应生成NaCl.
故答案为:
(1)CuSO4; CuSO4溶液为蓝色;
(2)Na2CO3; CaCl2;
(3)不一定;Na2CO3与稀盐酸反应能生成NaCl,无法判断原固体中是否含有NaCl.
点评 在解此类题时,首先分析题中所给物质的性质,然后依据题中的现象确定各种物质的存在性,最后确定混合物的成分


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
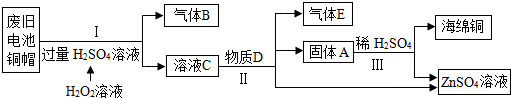
 能源是社会关注的主要问题之一.
能源是社会关注的主要问题之一.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 具有吸附性,可处理海上石油泄漏 | B. | 常温下化学性质活泼 | ||
| C. | 在一定条件下可还原氧化铜 | D. | 在氧气中完全燃烧的产物是CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质质量/g | 8 | 32 | 5 | 4 |
| 反应后物质质量/g | 16 | 4 | x | 24 |
| A. | 该反应为分解反应 | |
| B. | 丙可能为该反应的催化剂 | |
| C. | 该反应中甲、乙两种物质间的质量比为1:4 | |
| D. | 乙中含有两种或两种以上元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
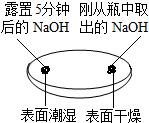 | 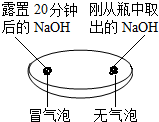 |  |
| 实验一 | 实验二 | 分析 |
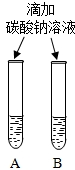 | 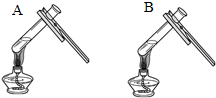 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 酸雨的pH小于5.6,所以pH小于5.6的雨水一定是酸雨 | |
| B. | 碱溶液能跟某些非金属氧化物反应,所以碱溶液能吸收一氧化碳气体 | |
| C. | 酸性溶液能使紫色石蕊溶液变红,所以能使紫色石蕊溶液变红的溶液呈酸性 | |
| D. | 碳酸盐与稀盐酸反应生成气体,所以与稀盐酸反应生成气体的物质一定是碳酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com