
| A. | 催化剂参与反应活性研究 | B. | 金属变质机理 | ||
| C. | 汽车尾气催化转化处理 | D. | 氮气催化氧化机理 |
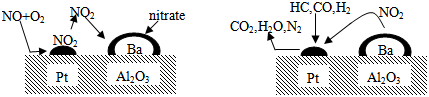
分析 由图中信息可知,汽车尾气中的一氧化氮和氧气在催化剂表面反应生成二氧化氮,二氧化氮和硝酸盐反应生成其它物质,从而达到处理一氧化氮的目的;
二氧化氮和碳氢化合物、一氧化碳、氢气在催化剂作用下反应生成二氧化碳、水和氮气,从而达到处理二氧化氮、碳氢化合物、一氧化碳和氢气的目的.
解答 解:由左图可知,汽车尾气中的一氧化氮和氧气在催化剂表面反应生成二氧化氮,二氧化氮和硝酸盐反应生成其它物质,从而达到处理一氧化氮的目的;
由右图可知,二氧化氮和碳氢化合物、一氧化碳、氢气在催化剂作用下反应生成二氧化碳、水和氮气,从而达到处理二氧化氮、碳氢化合物、一氧化碳和氢气的目的,因此该机理研究是指汽车尾气催化转化处理.
故选:C.
点评 汽车尾气中含有一氧化碳、一氧化氮、二氧化氮、碳氢化合物等物质,这些物质扩散到空气中会污染环境,因此要进行处理.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
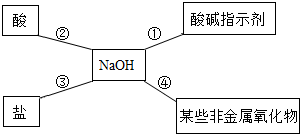 小红同学用如图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应).
小红同学用如图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应).查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气$\stackrel{液化}{→}$液态空气$\stackrel{分离}{→}$氧气 | |
| B. | 二氧化碳$\stackrel{绿色植物}{→}$氧气 | |
| C. | 高锰酸钾(KMnO4)$\stackrel{加热}{→}$锰酸钾(K2MnO4)+二氧化锰(MnO2)+氧气(O2) | |
| D. | 过氧化氢(H2O2)$\stackrel{二氧化锰}{→}$水(H2O)+氧气(O2) |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液的质量 | B. | 溶质的质量分数 | C. | 溶质的质量 | D. | 氯化铵的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com