
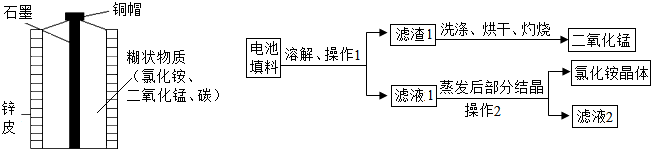
| 实验序号 | 不同纯度的锌 | 硫酸的质量分数/% | 反应温度/℃ | 锌消失的时间/s |
| Ⅰ | 含杂质锌 | 3 | 20 | 200 |
| Ⅱ | 纯锌 | 3 | 20 | 500 |
| Ⅲ | 纯锌 | 6 | 20 | 300 |
| Ⅳ | 纯锌 | 6 | 30 | 80 |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| A、回收铝饮料罐可以节约金属资源 |
| B、回收一个铝饮料罐比制造一个铝饮料罐要贵 |
| C、回收铝饮料罐可以减少对环境的污染 |
| D、回收铝饮料罐可以节约能源 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、缺钙会引起侏儒症 |
| B、缺碘会引起甲状腺疾病 |
| C、缺铁 易得贫血症 |
| D、缺锌会使儿童发育停滞 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 |
| (1)取样,溶于适量的水 | 形成无色溶液 | 猜想 |
| (2)取少量品尝 | 有苦涩味 | 不是 |
| (3)向(1)的溶液中滴加酚酞试液 | 溶液变红 | 是纯碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?
实验室中有一瓶标签受损的无色液体,如图所示.这瓶无色液体是什么呢?| 实验操作 | 实验现象 | 实验结论 |
| 没有沉淀产生. | 该液体不是硫酸钠溶液. | |
| 该液体是氯化钠溶液. |
查看答案和解析>>
科目:初中化学 来源: 题型:
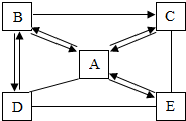 A、B、C、D、E为初中五种常见物质,其中A是生活中最常见液体,B、D是气体,只有E含金属元素,B是常见单质(反应条件与其他物质均已略去).“→”表示按方向一步转化,“--”表示两种物质间可以发生反应,所有反应都是初中常见反应.
A、B、C、D、E为初中五种常见物质,其中A是生活中最常见液体,B、D是气体,只有E含金属元素,B是常见单质(反应条件与其他物质均已略去).“→”表示按方向一步转化,“--”表示两种物质间可以发生反应,所有反应都是初中常见反应.查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体的于试管中,加水振荡制直至完全溶解. | 猜想Ⅰ不成立. | |
| ②取少量①的溶液于试管中,滴加过量的Ba(NO3)2溶液. | 证明有Na2CO3存在.化学反应方程为: | |
| ③取少量②的溶液于试管中,滴加无色酚酞试液. | 证明NaOH存在. | |
| 结合以上实验现象,说明猜想Ⅱ是成立的. | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com