


| 装置C/g | 装置D/g | 装置E/g | |
| 加热前 | 200.00 | 180.00 | 180.00 |
| 加热后 | 201.08 | 180.44 | 180.00 |
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3•2Ni(OH)2+3Na2SO4+2X,反应前Ni原子共3个、S原子共3个、O原子共23个、Na原子6个、C原子3个、H原子4个,反应后现有:Ni原子3个、S原子共3个、O原子共19个、Na原子6个、C原子1个、H原子4个,少O原子4个,C原子2个,而这些微粒包含在2个X分子中,所以X的化学式为 CO2.
(2)
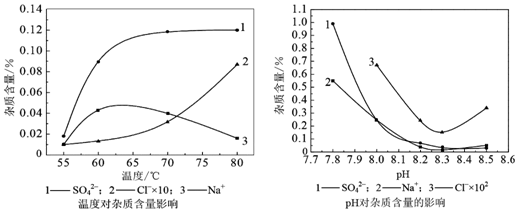
物料在反应器中反应时需要控制反应条件.根据图可知,在55℃时杂质含量最低,在pH=8.3时各种杂质相对最少,所以反应器中最适合的温度及pH分别为 55℃、8.3.
(3)生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,由于在氢氧化镍中镍元素含量比在纯净的碱式碳酸镍中高,所以随着氢氧化镍的含量相对增加,则生成的碱式碳酸镍晶体中,镍的含量将 升高.
(4)操作1是实现难溶性固体和液体分离的,在实验室中该操作为过滤(也可以根据操作结果为滤液得出此操作为过滤).实验室完成过滤操作时,需要的玻璃仪器是烧杯、玻璃棒及 漏斗,其中玻璃棒的作用是 引流.
(5)固体洗涤时,需用纯水洗涤,洗涤只要是除去表面附着的硫酸钠的,所以检验是否洗涤干净就是检验是否留硫酸根离子的残留,用含钡离子的可溶性溶液即可,可以是钡盐也可以是钡碱.
(6)气体Y是空气中含量最多的气体,空气中氮气占体积的大约五分之四,所以是 氮气).
(7)操作2含过滤、水洗、95%酒精浸泡、晾干等操作,由于酒精易挥发,所以用95%酒精浸泡的目的是 便于快速晾干.
II、【测定碱式碳酸镍晶体的组成】:
(8)完善实验步骤中的填空:①检查装置气密性(保证后续数据准备和实验的安全顺利进行);⑤缓缓通空气一段时间(将装置内二氧化碳和水蒸气完全排出,使测定结果更准确,计算结果更准确.
(9)水的质量为201.08g-200g=1.08g
二氧化碳的质量为180.44g-180h=0.44g
由于发生的是分解反应,所以生成的NiO的质量为3.77g-1.08g-0.44g=2.25g
则分解反应中水、二氧化碳和NiO的系数比(也就是分子个数比)为$\frac{1.08g}{18}$:$\frac{0.44g}{44}$:$\frac{2.25g}{77}$=6:1:3
即:xNiCO3•yNi(OH)2•zH2O$\frac{\underline{\;\;△\;\;}}{\;}$6H2O↑+1CO2↑+3NiO
可得x=1
y=2
z=4
即xNiCO3•yNi(OH)2•zH2O中x:y:z的值 1:2:4.
(10)左侧通空气的目的是 开始是为了排尽装置中原有的CO2和水蒸气,避免装置内的二氧化碳和水蒸气造成数据干扰;反应后是为了将装置B中的CO2和水蒸气完全排出,使计算结果更准确.
【实验反思】:
(11)根据关系式以及 xNiCO3•yNi(OH)2•zH2O的质量为3.77g可得
NiCO3•2Ni(OH)2•4H2O~~~3NiO~~~3Ni~~~3O
3.77 225 177 48
3.77g 2.25g 1.77g 0.48g
∵装置B中残留固体质量为2.33g
∴残留固体中O元素质量为2.33g-1.77g=0.56g,大于0.48g
残留固体中Ni、O元素质量比为1.77g:0.56g=177:56
而NiO及Ni2O3中Ni、O元素质量比分别为177:48、177:72,故残留固体为NiO和Ni2O3的混合物.
残留固体质量增加2.33g-2.25g=0.08g,是和NiO反应的O2质量
设与氧气反应的NiO质量为x 生成的Ni2O3质量为y
4 NiO+O2 $\frac{\underline{\;400℃\;}}{\;}$2Ni2O3
300 32 332
x 0.08g y
$\frac{300}{x}$=$\frac{32}{0.08g}$=$\frac{332}{y}$
x=0.75g
y=0.83g
剩余NiO质量为2.25g-0.75g=1.5g,生成Ni2O3 0.83g.
故答案为:
(1)CO2;
(2)55; 8.3;
(3)升高;
(4)过滤; 漏斗; 引流;
(5)BaCl2溶液或Ba(NO3)2溶液或Ba(OH)2溶液(答AgNO3溶液不给分,因为洗涤液中Cl-含量很低);
(6)氮气(填化学式不给分);
(7)便于快速晾干;
(8)①检查装置气密性; ②缓缓通空气一段时间;
(9)1:2:4;
(10)排尽装置中原有的CO2和水蒸气; 将装置B中的CO2和水蒸气完全排出;
(11)根据关系式以及 xNiCO3•yNi(OH)2•zH2O的质量为3.77g可得
NiCO3•2Ni(OH)2•4H2O~~~3NiO~~~3Ni~~~3O
3.77 225 177 48
3.77g 2.25g 1.77g 0.48g
∵装置B中残留固体质量为2.33g
∴残留固体中O元素质量为2.33g-1.77g=0.56g,大于0.48g
残留固体中Ni、O元素质量比为1.77g:0.56g=177:56
而NiO及Ni2O3中Ni、O元素质量比分别为177:48、177:72,故残留固体为NiO和Ni2O3的混合物.
残留固体质量增加2.33g-2.25g=0.08g,是和NiO反应的O2质量
设与氧气反应的NiO质量为x 生成的Ni2O3质量为y
4 NiO+O2 $\frac{\underline{\;400℃\;}}{\;}$2Ni2O3
300 32 332
x 0.08g y
$\frac{300}{x}$=$\frac{32}{0.08g}$=$\frac{332}{y}$
x=0.75g
y=0.83g
剩余NiO质量为2.25g-0.75g=1.5g,生成Ni2O3 0.83g.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:初中化学 来源: 题型:实验探究题
 淡水资源的缺乏已成为制约社会发展的重要因素,从浩瀚的海洋里获取淡水,对解决淡水危机具有重要意义.某小组针对这一现状,提出问题并在实验室进行了以下探究.
淡水资源的缺乏已成为制约社会发展的重要因素,从浩瀚的海洋里获取淡水,对解决淡水危机具有重要意义.某小组针对这一现状,提出问题并在实验室进行了以下探究.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是各物质间的反应均在溶液中进行.已知甲、乙为化合物,丙为单质.下列说法中不正确的是( )
如图是各物质间的反应均在溶液中进行.已知甲、乙为化合物,丙为单质.下列说法中不正确的是( )| A. | X是氯化镁溶液 | B. | 甲一定是氧化镁 | ||
| C. | 丙与CuCl2的反应类型是置换反应 | D. | 丙是金属,并且活动性比铜强 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 同学们在实验室发现有一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分(如图)无法辨认具体是什么物质的溶液,只能看出溶质的质量分数为10%,经询问老师知道可能是氢氧化钠、氯化钠、氢氧化钙或碳酸钠溶液中的一种.为探究其成分,化学兴趣小组的同学进行如下探究,请你共同参与:
同学们在实验室发现有一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分(如图)无法辨认具体是什么物质的溶液,只能看出溶质的质量分数为10%,经询问老师知道可能是氢氧化钠、氯化钠、氢氧化钙或碳酸钠溶液中的一种.为探究其成分,化学兴趣小组的同学进行如下探究,请你共同参与:| 氢氧化钠 | 氯化钠 | 氢氧化钙 | 碳酸钠 | |
| 溶解度/g(20℃) | 51 | 36 | 0.16 | 21.5 |
| 实验操作及步骤 | 实验现象 | 实验结论 |
| 取少量样品溶液于试管中,滴加氯化钙溶液 | 有白色沉淀产生 | 该溶液是碳酸钠溶液 |
| 取少量样品溶液于试管中,滴加稀盐酸 | 有气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 3.9g | B. | 4g | C. | 7.9g | D. | 16.9g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com