
 实验室有一瓶标签受到腐蚀的无色溶液,如图所示.这瓶无色溶液是放在存放盐溶液的柜子里.化学兴趣小组开展探究:
实验室有一瓶标签受到腐蚀的无色溶液,如图所示.这瓶无色溶液是放在存放盐溶液的柜子里.化学兴趣小组开展探究:| 实验操作 | 实验现象 |
| ①取少重该无色溶液于试管中,慢慢滴加BaCl2溶液 ②静置后,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大量气泡,沉淀全部溶解. |
| 实验操作 | 实验现象 |
| 取上述无色溶液少许于试管中,滴加少量的稀盐酸 | 溶液中没有气泡产生(或有气泡产生),该瓶无色溶液是硫酸钠溶液(或碳酸钠溶液) |
分析 根根据题干提供的信息进行分析,残缺的标签中钠元素的右下角有数字2,且含有氧元素,故不可能是氯化钠、碳酸氢钠和硝酸钠,可以据此完成(1)(2)两小题;
[实验结论]硫酸钠溶液和碳酸钠溶液都能与氯化钡溶液反应生成白色沉淀,但是碳酸钡沉淀能和盐酸反应产生气体,而硫酸钡不能溶于稀盐酸,可以据此完成解答;
(3)碳酸钠的水溶液呈碱性,而硫酸钠的水溶液呈中性,可以使用测定溶液pH的方法或加入指示剂的方法来确定物质的成分,可以据此设计实验来进行判段;
(4)根据碳酸盐能与盐酸反应生成二氧化碳气体,据此解答即可;
(5)根据pH试纸可以测量溶液的pH值,根据pH>7为碱性解答.
解答 解:(1)氯化钠是由钠元素和氯元素组成的,不含有氧元素,故一定不会是氯化钠溶液,故填:氯化钠;
(2)此标签中钠元素右下角的数字为2,而碳酸氢钠的化学式为NaHCO3,硝酸钠的化学式为NaNO3,故不会是碳酸氢钠和硝酸钠,故填:碳酸氢钠和硝酸钠的化学式中钠元素右下角的数字为1;
(3)硫酸钠能与氯化钡反应生成硫酸钡沉淀,但是硫酸钡沉淀不溶于盐酸,滴加盐酸不会出现溶解的情况,故不会是硫酸钠;碳酸钠与氯化钡湖反应生成碳酸钡沉淀,碳酸钡沉淀能溶于盐酸且产生气体,故该瓶溶液是碳酸钠溶液,故填:Na2CO3,Na2CO3+BaCl2=BaCO3↓+2NaCl;
(4)碳酸钠能与盐酸反应生成二氧化碳气体,而硫酸钠不能与盐酸反应,故可以直接向溶液中加入盐酸,观察是否产生气泡,故填:
| 实验操作 | 实验现象 |
| 取上述无色溶液少许于试管中,滴加少量的稀盐酸 | 溶液中没有气泡产生(或有气泡产生),该瓶无色溶液是硫酸钠溶液(或碳酸钠溶液) |
| 实验操作 | 实验现象 |
| 取上述无色溶液少许于试管中,滴加少量的稀盐酸 | 溶液中没有气泡产生(或有气泡产生),该瓶无色溶液是硫酸钠溶液(或碳酸钠溶液) |
点评 本题考查了破损标签瓶中试剂的确定,完成此题,可以依据破损标签中所含有的元素以及有关物质的性质进行分析及设计实验.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
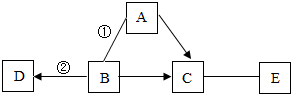 A~E为初中化学常见的物质.他们有如图所示的转化关系,图中“-”表示相连的物质间能相互发生反应,“→”表示物质间有相应的转化关系.其中,A、B都是黑色固体,通常状况下,C是一种能使澄清石灰水变浑浊的气体,D溶于水会形成蓝色溶液,常用于配制一种具有杀菌作用的农药.请回答下列问题:
A~E为初中化学常见的物质.他们有如图所示的转化关系,图中“-”表示相连的物质间能相互发生反应,“→”表示物质间有相应的转化关系.其中,A、B都是黑色固体,通常状况下,C是一种能使澄清石灰水变浑浊的气体,D溶于水会形成蓝色溶液,常用于配制一种具有杀菌作用的农药.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
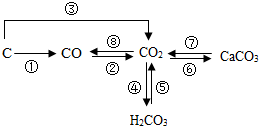 如图是部分含碳物质的转化关系图,根据图示判断下列说法正确的是( )
如图是部分含碳物质的转化关系图,根据图示判断下列说法正确的是( )| A. | ①②③⑧都只能通过化合反应实现 | |
| B. | ⑤⑦均可用于实验室制取CO2 | |
| C. | 将CO2通入紫色石蕊溶液中,溶液变红,可用④来解释原因 | |
| D. | 图中物质均为含碳元素的化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 新材料的出现促进了社会的进步,晶体硅是信息是被重要的材料.工业上生产高纯硅有以下两个重要环节;
新材料的出现促进了社会的进步,晶体硅是信息是被重要的材料.工业上生产高纯硅有以下两个重要环节;查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 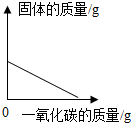 实验室用一氧化碳还原氧化铁 | |
| B. | 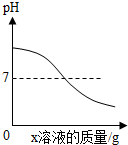 往氢氧化钙溶液中逐滴加入蒸馏水 | |
| C. |  向盐酸和氯化钙的混合溶液中逐滴加入碳酸钾溶液 | |
| D. | 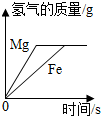 将足量粉末状金属分别与等质量、等质量分数的稀盐酸反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | Z>X>M>Y | B. | X>Z>M>Y | C. | X>Z>Y>M | D. | Y>M>Z>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com