
【题目】中和反应是一类重要的化学反应:
①能与稀硫酸发生中和反应的_____________
A 氢氢化钡 B 碳酸钠 C 镁带 D 氧化铜
②小组同学将氢氧化钠溶液和稀盐酸混合反应。实验装置如图,采用无色酚酞试液作酸碱指示剂,用传感器分别测定溶液pH、溶液温度的变化情况。请写出该中和反应的化学方程式:____________。根据表格数据回答:

滴加液体的体积(毫升) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
pH | 13.1 | 12.8 | 12.3 | 11.5 | 10.4 | 7.0 | 2.7 | 2.3 | 2.2 | 2.1 | 2.0 |
温度(℃) | 25.5 | 25.8 | 26.1 | 26.4 | 26.8 | 27.0 | 26.9 | 26.8 | 26.7 | 26.6 | 26.6 |
③混合前,烧杯内的是_______________溶液,判断的依据是________。
④当滴加液体体积为________________mL时,酸碱中和反应恰好完成。根据表格数据可判断;中和反应是____________(填“吸热”“放热”或“无变化”)的反应,理由是__________
⑤当滴加液体6mL时,烧杯中的溶质(除酚酞以外)有________(填化学式);若酚酞无色则滴加液体的体积可能是___________mL
A 4 B 8 C 10 D 14
⑥有同学发现在实验过程中,开始时没有气泡,持续滴加液体后,观察到有气泡产生,请分析可能的原因________,并设计实验证明你的结论________________
⑦现有两杯质量相同、溶质质量分数相同的NaOH溶液和KOH溶液,在NaOH溶液中加入xg盐酸恰好中和;在KOH溶液中加入yg上述盐酸也能恰好中和,则x____________y
A > B < C = D 无法判断
【答案】A NaOH+HCl=NaCl+H2O 氢氧化钠 随着溶液的滴加,混合溶液的pH逐渐减小 10 放热 溶液的pH由13.1变为7的过程中溶液的温度逐渐升高 NaOH和NaCl CD 氢氧化钠变质 取少许溶液,滴入少量的氯化钙溶液或澄清的石灰水,观察到有白色沉淀生成 B
【解析】
①能与稀硫酸发生中和反应的物质属于碱,A 氢氢化钡属于碱,可以与酸发生中和反应,选项正确;
B 碳酸钠属于盐,虽然能与硫酸反应,但不属于中和反应,选项错误;
C 镁带与硫酸反应生成硫酸镁和氢气,是金属单质与酸的反应,不属于中和反应,选项错误;
D 氧化铜属于金属氧化物,与硫酸德 反应不属于中和反应,选项错误,故填A。
②氢氧化钠与盐酸反应生成氯化钠和水,故反应的化学方程式写为:NaOH+HCl=NaCl+H2O。
③由图可知,混合前烧杯内的溶液的pH为13.1,溶液显碱性,所以混合前的溶液是氢氧化钠溶液,故填氢氧化钠;
由图可知,随着溶液的滴加,混合溶液的pH逐渐减小,说明是将酸性溶液滴入碱性溶液中,故填随着溶液的滴加,混合溶液的pH逐渐减小。
④由图可知,当滴加液体体积为10mL时,溶液的pH为7,则酸碱中和反应恰好完成,故填10;
由图可知,中和反应是放热的反应,故填放热;
表中当溶液的pH由13.1变为7的过程中溶液的温度逐渐升高,证明中和反应是放热的反应,故填溶液的pH由13.1变为7的过程中溶液的温度逐渐升高。
⑤当滴加液体6mL时,溶液的pH为11.5,溶液显碱性,则溶液中的溶质烧杯中的溶质(除酚酞以外)还有未反应的氢氧化钠和反应生成的氯化钠,其化学式分别为NaOH和NaCl,故填NaOH和NaCl;
若酚酞无色,则溶液显酸性或中性,由图可知,A 当加入4mL液体时,溶液的pH为12.3,溶液显碱性,选项错误,B 当加入液体为8mL时,溶液的pH为10.4,溶液显碱性,选项错误,C 当加入液体为10mL时,溶液的pH为7,溶液显中性,选项正确,D 当加入液体14mL时,溶液的pH为2.3,溶液显酸性,选项正确,故填CD。
⑥持续滴加液体后,观察到有气泡产生是因为氢氧化钠与空气中的二氧化碳反应变质生成碳酸钠和水,碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,故填氢氧化钠变质;
取少许溶液,滴入少量的氯化钙溶液或澄清的石灰水,观察到有白色沉淀生成,说明氢氧化钠变质,故填取少许溶液,滴入少量的氯化钙溶液或澄清的石灰水,观察到有白色沉淀生成。
⑦解:质量相同、溶质质量分数相同的NaOH溶液和KOH溶液中NaOH与KOH的质量相同
设质量为m的氢氧化钠消耗的盐酸的质量为x
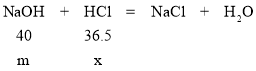
40:36.5=m:x x=![]()
设质量为m的氢氧化钾消耗的盐酸的质量为y
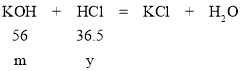
56:36.5=m:y y=![]()
![]() <
<![]() ,即x<y,故填B。
,即x<y,故填B。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】某化学兴趣小组分组进行探究CO2的性质实验,他们分别发挥自己的智慧设计实验进行探究。
(分组实验)甲组:如图1,向一个收集满CO2气体的软质塑料瓶中倒入约1/3体积的水,立即拧紧瓶盖,振荡,观察到_____,从而得出二氧化碳溶于水的结论。随后又向反应后的瓶中滴加紫色石蕊溶液,观察到溶液变为红色,从而又得出_____的结论。再将水换成浓NaOH溶液重复实验,发现瓶子变得更瘪,对比之后可得出结论:_____(用化学方程式表示)。
乙组:如图2甲所示,用注射器将水压入装满CO2气体并连接有压强传感器的集气瓶中,通过测定瓶内压强变化探究CO2的性质;再将水换成浓NaOH溶液重复实验。两次实验中的压强变化如图2乙所示。

作图2甲实验时,小明先堵住导管,向外拉注射器活塞,松开后活塞回到原位,其目的是:_____。
(交流讨论)乙组同学通过实验得出压强随时间变化的曲线,请你对以下走势做出合理说明。
(1)AB段:_____;
(2)BC段:_____;
(3)乙组同学通过分析加水前后压强几乎不变,于是得出CO2难溶于水的结论。你同意吗?并说明理由:_____。
(4)乙组同学用浓NaOH溶液进行实验时,也证明CO2能与NaOH溶液反应,但实验时压强没有下降到零,原因可能是_____;
(5)甲、乙两组同学都证实了CO2能与NaOH溶液反应。请你再设计一个实验证明_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
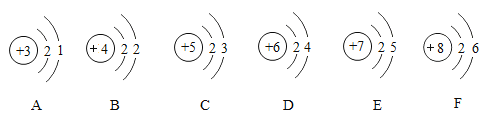
【题目】下图一是某金属元素形成微粒的结构示意图。

请根据以上信息回答问题:
(1)图一所示微粒的符号为________;下图中与该金属元素的原子化学性质相似的是_____________。(填序号)
(2)利用图二所示实验装置制取氧气,能够用图二收集氧气的原因是________;若选择高锰酸钾制取氧气,写出高锰酸钾的化学式并标出锰元素化合价________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯酸钾和二氧化锰的混合物制取氧气如图,分析不正确的是 ( )
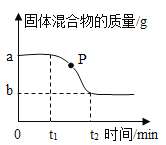
A.反应结束时一定能收集到![]() 氧气
氧气
B.P点处固体成分是氯酸钾和氯化钾
C.在氯酸钾分解过程中氯元素的质量分数不断增大
D.在![]() 时段,
时段,![]() 在混合物中的质量分数不断增大
在混合物中的质量分数不断增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学设计并进行了CO2的制取与性质的实验。
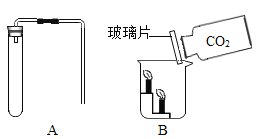
制取与性质:如图A,检查装置的气密性,操作为_____,观察到导管口有气泡冒出。然后加入药品,固定装置,制取CO2,有关化学方程式_____。如图B,现象为_____,说明CO2的性质是_____。由此推知,一般情况下可燃物燃烧的条件之一是_____。
反思与交流:(1)制备气体时选择发生装置需考虑的因素有_____。
(2)欲证明人吸入的空气与呼出的气体中CO2的含量不同,你的实验操作是:取一瓶空气、一瓶等体积的呼出气体,_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图中,A、B、甲、乙、丙均是初中化学常见的纯净物,其中甲、乙、丙物质的类别相同。甲、丙和足量的A反应能生成相同的生成物。A、B均含两种元素,其混合物有挥发性,挥发出的气体能使湿润的蓝色石蕊试纸变红色。丙中含氧45.3%,广泛应用于玻璃、纺织的生产等。图中“﹣”表示两端的物质间能发生化学反应;“→”表示物质间存在相应的转化关系,部分反应物、生成物及反应条件已略去。下列推断错误的是( )

A.甲、乙、丙均属于盐类
B.丙和A溶液发生的是复分解反应
C.甲→乙的转化通过一步反应也可实现
D.甲和丙都能与氯化钙溶液反应生成白色沉淀
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示碱与不同类别物质之间的性质关系(“—”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已省略),请回答问题。
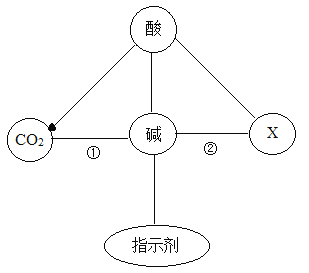
(1)X的物质类别____________。
(2)根据性质①写出检验CO2的化学反应方程式__________________________。
(3)根据性质②写出能体现碱的相似化学性质的反应方程式__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】物质都是由微观粒子构成的。在构成下列四种物质的微粒示意图中, “○”和“![]() ”分别表示氢和氧两种元素的原子。
”分别表示氢和氧两种元素的原子。
物 质 | 甲 | 乙 | 丙 | 丁 |
构成该物质的粒子 |
|
|
|
|
(1)四种物质中,属于单质的是__________(填物质代号,下同)。
(2)四种物质中,不同种元素原子个数比为1:1的是___________,含有H2分子的是___________。
(3)甲物质在一定条件下反应可生成丙,该反应的化学方程式为______________,该反应属于________反应(填“化合”或“分解”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com