(2011?北海)某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗NaOH溶液80g,洗涤后溶液呈中性.(反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O)
请计算:
(1)这一定量石油产品中含H2SO4的质量.
(2)若所用的氢氧化钠溶液是用40%的氢氧化钠溶液稀释而成,则稀释过程中需要加水的质量.
【答案】
分析:根据溶质质量分数公式以及化学方程式进行计算,氢氧化钠能与硫酸反应生成硫酸钠和水,溶液加水稀释前后溶质的质量不变.
解答:解:(1)解:设H
2SO
4的质量为x
NaOH的质量:80g×10%=8g
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98
8g x
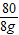
=
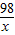
x=9.8g
(2)溶液加水稀释溶质的质量不变,
解:方法一:设浓溶液质量为y
y×40%=8g×10%
y=20g
水的质量:80g-20g=60g
方法二:设稀释过程中需加水的质量为m
(80g-m)×40%=80g×10%
m=60g
答:(1)石油产品中含H
2SO
4的质量为9.8g,
(2)稀释过程中需要加水的质量为60g.
点评:本题考查了根据化学方程式进行的计算以及溶液稀释的有关计算,完成此题,可以依据氢氧化钠与硫酸反应的质量关系以及溶液稀释溶质质量不变进行.

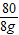 =
=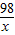


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
