
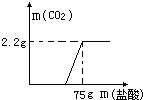
 某化学兴趣小组对实验室留置的NaOH的变质程度进行探究.先称取13.3gNaOH样品(杂质为Na2CO3 ),配制成50g溶液,然后向溶液中逐滴加入质量分数为14.6%稀盐酸,实验测得加入稀盐酸的质量与产生CO2 气体的质量关系如图.试计算:
某化学兴趣小组对实验室留置的NaOH的变质程度进行探究.先称取13.3gNaOH样品(杂质为Na2CO3 ),配制成50g溶液,然后向溶液中逐滴加入质量分数为14.6%稀盐酸,实验测得加入稀盐酸的质量与产生CO2 气体的质量关系如图.试计算:| 106 |
| 44 |
| x |
| 2.2g |
| 117 |
| 44 |
| y |
| 2.2g |
| 80 |
| 106 |
| z |
| 5.3g |
| 40 |
| 58.5 |
| 8g |
| p |
| 5.85g+11.7g |
| 50g+75g-2.2g |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:
| 金属 | Cr | Al | Cu |
| 与盐酸反应发生现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
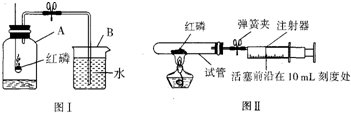
| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| 1 |
| 5 |
| 1 |
| 5 |
| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
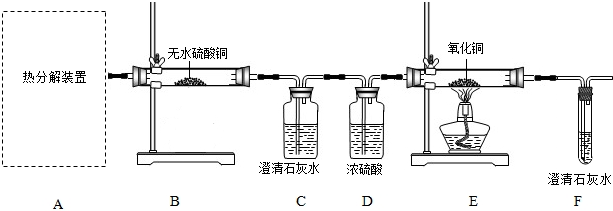
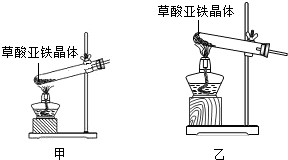
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com