
化学小组的同学设计了下图所示装置,用以探究碱的有关性质。
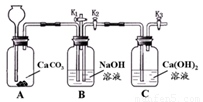
(1)打开K1关闭K2,从长颈漏斗加入足量稀盐酸,A中发生反应的化学方程式为 。
(2)一段时间后,关闭K1,打开K2和K3,C中发生反应的化学方程式为 。该过程中观察到的现象是 。
(3)小组同学预想的部分现象没有出现,可能与装置的气密性不好有关,检查该装置气密性的方法是 。
(1)CaCO3+2HCl = CaCl 2+CO2↑+H2O
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ;B中有气泡冒出,液体沿右侧导气管流入C中,C中溶液变混浊。
(3)关闭K1和K3 ,打开K2,从长颈漏斗倒入水,水不能顺利流入,在长颈漏斗中形成液柱,并保持,说明装置气密性良好。
【解析】
试题分析:(1)A中是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;(2)C中发生的反应为碳酸钠和氢氧化钙反应,生成碳酸钙和氢氧化钠,该过程中观察到的现象是B中有气泡冒出,液体沿右侧导气管流入C中,C中溶液变混浊;(3)检查该装置气密性的方法为关闭K1和K3 ,打开K2,从长颈漏斗倒入水,水不能顺利流入,在长颈漏斗中形成液柱,并保持,说明装置气密性良好。
考点:探究碱的性质
点评:常见的化学反应经常作为探究题的素材出现,中考题中经常有考察,但不是每年都出大题,有时在选择题中出现,这种题要是平时要注意积累和总结。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:初中化学 来源: 题型:
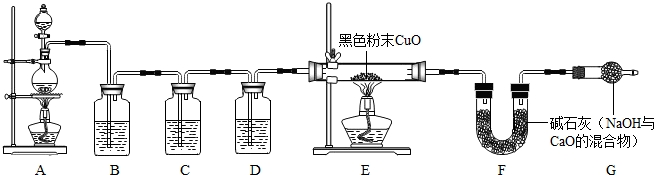
 32、收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3
32、收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| A |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:
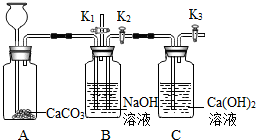 (2013?顺义区二模)化学小组的同学设计了下图所示装置,用以探究碱的有关性质.
(2013?顺义区二模)化学小组的同学设计了下图所示装置,用以探究碱的有关性质.查看答案和解析>>
科目:初中化学 来源:2013年北京市顺义区中考化学二模试卷(解析版) 题型:填空题
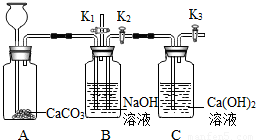
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com