
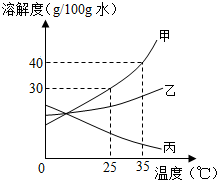
 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答以下问题:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答以下问题:分析 (1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(2)据该温度下甲的溶解度分析解答;
(3)甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以提纯甲可采取降温结晶的方法;
(4)等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多,并结合物质的溶解度变化及饱和溶液中溶质的质量分数计算解答;
(5)不饱和溶液变为饱和溶液可采取降温、蒸发溶剂、加入溶质的方法,并结合题意解答.
解答 解:(1)25°C时,甲的溶解度>乙的溶解度.
(2)25°C时甲的溶解度是30g,即100g水中最多溶解30g 的甲,所以将50g甲固体加入到100g水中,充分溶解并恢复到原温度后,最多溶解30g,得到溶液的质量为 130g.
(3)甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以提纯甲可采取降温结晶的方法,具体操作步骤是:溶解,加热浓缩,降温结晶,过滤;
(4)将35°C时,将等质量的甲、乙、丙三种物质饱和溶液同时降温到10°C,析出晶体是多的是甲,因为其溶解度变化最大;降温甲乙的溶解度均减小、析出晶体,则溶质的质量分数减小,而丙的溶解度变大,溶质质量分数与降温前相同;饱和溶液中溶质质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大则溶质的质量分数大,而降温后甲乙的溶解度相等大于降温前丙的溶解度,故所得溶液中溶质质量分数最小的是丙.
(5)将35°C时接近饱和甲溶液变成该温度下的饱和溶液,可采取恒温蒸发溶剂或加入溶质的方法;
A.若采取加入溶质的方法,则溶剂质量不变,故错误;
B.若采取恒温蒸发溶剂的方法,则溶质的质量不变,若加入溶质、则溶质质量增加,正确;
C.同一温度下饱和溶液的溶质质量分数最大,故溶质的质量分数一定变大,正确;
D.若采取恒温蒸发溶剂的方法,则溶液的质量减小,故错误;
故答案为:(1)>;(2)130;(3)adcb;(4)甲;丙;(5)BC.
点评 本考点考查了溶解度曲线及其应用、物质的溶解度,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的饱和与不饱和的相互转化等知识,能较好考查学生对知识的掌握和应用能力.


科目:初中化学 来源: 题型:推断题
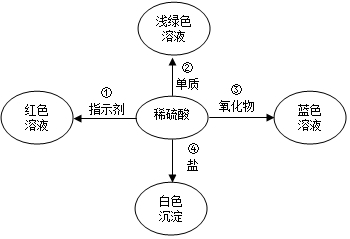 化学使世界变得绚丽多彩.如图是物质之间发生化学反应的颜色变化,稀硫酸与不同的物质反应呈现出不同的颜色.
化学使世界变得绚丽多彩.如图是物质之间发生化学反应的颜色变化,稀硫酸与不同的物质反应呈现出不同的颜色.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 根据图示信息,用化学用语填空:
根据图示信息,用化学用语填空:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③④ | C. | ③④ | D. | 只有④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
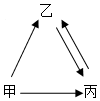 甲、乙、丙是初中化学常见的三种物质,都含有地壳中含量最多的元素,其相互转化关系如图(其反应条件略),丙是单质,则甲的化学式为H2O2,乙转化为丙的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,甲、乙两种物质组成元素相同,性质却不相同,其原因是分子构成不同,性质不同.
甲、乙、丙是初中化学常见的三种物质,都含有地壳中含量最多的元素,其相互转化关系如图(其反应条件略),丙是单质,则甲的化学式为H2O2,乙转化为丙的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,甲、乙两种物质组成元素相同,性质却不相同,其原因是分子构成不同,性质不同.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com