
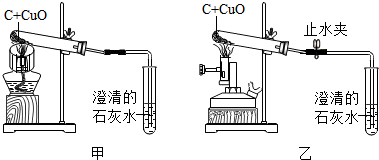
分析 (1)根据检查装置气密性的方法分析回答;
(2)根据碳与氧化铜的反应分析回答;
(3)根据实验的注意事项分析回答.
解答 解:(1)碳和氧化铜反应前需要先进行气密性检查,方法是将导管伸入水中,用酒精灯加热试管底部,观察导管口是否出现气泡;
(2)在选择氧化铜和碳的质量比例时要考虑到氧气消耗的炭,不能按反应的比例选择,碳粉要稍多一些,有利于反应充分进行.
2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
160 12即40:3,而碳粉稍微多一点,即在给定选项中选A.
(3)该小组按改进后的方案进行实验(图乙),待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却,终于获得了紫红色铜.若不关闭止水夹,可能出现的问题是水倒流入试管,使试管受热不均匀而破裂.
故答为:(1)将导管伸入水中,用酒精灯加热试管底部,观察导管口是否出现气泡;
(2)A;
(3)水倒流入试管,使试管受热不均匀而破裂.
点评 完成实验探究题时,要明确探究的目的,根据所给信息按步骤进行分析,认真思考反应中的现象,不放过细节问题.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
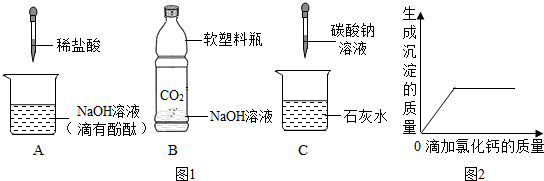
| 学生甲 | 还可能有Ca(OH)2、NaOH | 学生丙 | 还可能有Ca(OH)2、CaCl2 |
| 学生乙 | 还可能有NaOH、Na2CO3 | 学生丁 | 还可能有Na2CO3 |
| … | … |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
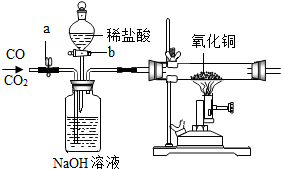 现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )
现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )| A. | 只收集到CO气体 | B. | 只收集到CO2气体 | ||
| C. | 先收集到CO气体,后收集到CO2气体 | D. | 先收集到CO2气体,后收集到CO气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 1 | 适量Ca(NO3)2溶液 | 过滤、蒸发、结晶 | 不可行,理由是引入了新杂质硝酸钠 |
| 2 | 过量的稀盐酸 | 蒸发结晶 | 可行 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X2Y | B. | XY2 | C. | X2Y3 | D. | X2Y5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com