用98%的硫酸配制10%的硫酸150mL,请计算出需浓硫酸________mL,加水量为________mL,(98%的硫酸密度为1.84g/cm3,
10%的硫酸密度为1.07g/cm3)(计算结果保留一位小数).操作方法是________.
8.9 144.1 向盛有144.1mL水的烧杯中沿器璧慢慢地倒入8.9mL浓硫酸,并用玻璃棒不断搅拌
分析:根据溶液在配制前后溶质的质量不变来计算需要的浓硫酸的体积,然后利用稀溶液质量减去浓溶液质量来计算加水的质量,浓溶液在稀释时放出大量的热,则应将浓硫酸加到水中去稀释来解答.
解答:由m=ρV和溶液在配制前后溶质的质量不变,
设需要浓硫酸的体积为V,则
150mL×1.07g/cm
3×10%=V×1.84g/cm
3×98%,
解得V=8.9mL;
加水的质量为150mL×1.07g/cm
3-8.9mL×1.84g/cm
3=144.1g,
则加水的体积为
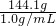
=144.1mL;
稀释浓硫酸为防止产生的热量造成液体迸溅,要及时散热,
则将密度大的液体加到密度小的液体中并用玻璃棒搅拌来散热,
即稀释的操作为:向盛有144.1mL水的烧杯中沿器璧慢慢地倒入8.9mL浓硫酸,并用玻璃棒不断搅拌;
故答案为:8.9;144.1;向盛有144.1mL水的烧杯中沿器璧慢慢地倒入8.9mL浓硫酸,并用玻璃棒不断搅拌.
点评:本题考查有关浓溶液的稀释及计算,学生应注意利用稀释前后溶质的质量不变来解答,并注意质量可以加和,但体积不能加和,同时注意稀释操作中浓硫酸放出大量的热,实验操作中有一定的危险来分析解答.

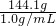 =144.1mL;
=144.1mL;

 24、下列是用98%浓硫酸配制500mla%的稀硫酸溶液的实验,请分析回答有关问题.
24、下列是用98%浓硫酸配制500mla%的稀硫酸溶液的实验,请分析回答有关问题.