
分析 (1)根据氢氧化钠的化学式和相对原子质量计算元素质量比;
(2)根据20℃时,NaCl的溶解度为36g进行分析;
(3)根据化学方程式和题中的数据进行计算.
解答 解:(1)NaOH中钠、氧、氢元素的质量比为:23:16:1;
(2)20℃时,NaCl的溶解度为36g,所以饱和溶液中溶质和溶剂的质量比为:36g:100g=9:25;
(3)设生成H2的质量为x,生成Cl2的质量为y
2NaCl+2H2O═2NaOH+H2↑+Cl2↑
2×58.5 2 71
36g×32.5% x y
$\frac{117}{36g×32.5%}$=$\frac{2}{x}$=$\frac{71}{y}$
x=0.2g
y=7.1g
剩余溶液的质量=136g?0.2g?7.1g=128.7g,
答:剩余溶液的质量为128.7g.
故答案为:(1)23:16:1;
(2)9:25;
(3)剩余溶液的质量为128.7g.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


科目:初中化学 来源: 题型:解答题
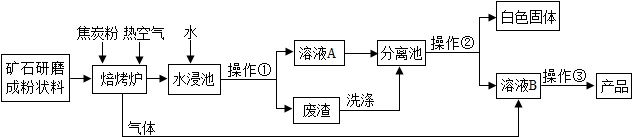
| 温度/℃ | 0 | 40 | 80 |
| Ca(OH)2溶解度/g | 0.187 | 0.141 | 0.094 |
| Ba(OH)2溶解度/g | 1.67 | 8.22 | 101.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
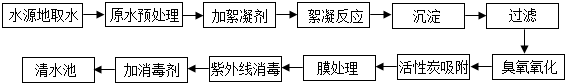
 纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产.
纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产. 所示.该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备.该酸雾腐蚀金属铁的化学方程式为Fe+2HCl═FeCl2+H2↑.
所示.该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备.该酸雾腐蚀金属铁的化学方程式为Fe+2HCl═FeCl2+H2↑.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
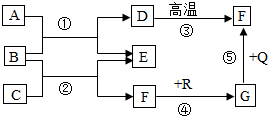 如图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体;Q、R都是黑色粉末;E是生活中常用的调味品(图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应条件和生成物略去).请回答:
如图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体;Q、R都是黑色粉末;E是生活中常用的调味品(图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应条件和生成物略去).请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com