

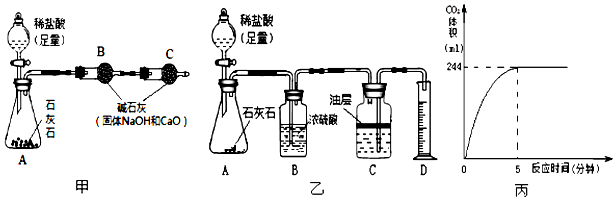
分析 (1)根据盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,第二次加盐酸,滤渣继续减少,说明第一次中盐酸完全反应且碳酸钙有剩余,可知50g盐酸完全消耗5g碳酸钙,而第二次减少的质量为2.9g,说明碳酸钙完全反应,剩余滤渣的质量就是石灰石样品中杂质的质量,以及在过滤操作中,需要用到的玻璃仪器有烧杯、漏斗、玻璃棒进行分析;
(2)根据碱石灰能吸收水蒸气和氯化氢气体,B中吸收二氧化碳中带出的水蒸气和氯化氢气体进行解答;
(3)根据二氧化碳体积和密度求出二氧化碳的质量,利用二氧化碳的质量求出碳酸钙的质量,进而求出该石灰石样品中CaCO3的质量分数即可.
解答 解:(1)盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,第二次加盐酸,滤渣继续减少,说明第一次中盐酸完全反应且碳酸钙有剩余,可知50g盐酸完全消耗5g碳酸钙,而第二次减少的质量为2.9g,说明碳酸钙完全反应,剩余滤渣的质量就是石灰石样品中杂质的质量,所以
的碳酸钙的质量分数=$\frac{10g-2.1g}{10g}$×100%=79%,在过滤操作中,需要用到的玻璃仪器有漏斗、玻璃棒、烧杯,故选:B;
(2)碱石灰能吸收水蒸气和氯化氢气体,B中吸收二氧化碳中带出的水蒸气和氯化氢气体,所以算得碳酸钙的质量分数,发现与事实严重不符;
(3)①C装置中油层的作用是防止二氧化碳溶于水;
②二氧化碳的质量=1.8g/L×0.244L≈0.44g,设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.44g
$\frac{100}{x}$=$\frac{44}{0.44g}$
x=1g
该石灰石样品中CaCO3的质量分数=$\frac{1g}{1.25g}$×100%=80%.
故答案为:(1)79%,B;
(2)B中吸收二氧化碳中带出的水蒸气和氯化氢气体;
(3)①防止二氧化碳溶于水;
②该石灰石样品中CaCO3的质量分数为:80%.
点评 本题考查学生利用化学反应方程式的计算,明确二氧化碳是气体并利用质量守恒来计算二氧化碳的质量是解答的关键.


科目:初中化学 来源: 题型:选择题
| A. | 一种元素的原子和另一种元素的离子 | |
| B. | 同种元素的原子和离子 | |
| C. | 一个物质的分子和离子 | |
| D. | 两种不同元素的离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水、干冰、盐酸溶液 | B. | 红磷、纯碱、石油 | ||
| C. | 氧气、生石灰、天然气 | D. | 金刚石、熟石灰、空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 制取Cu(OH)2:将适量CuO与NaOH溶液混合,过滤 | |
| B. | 分离氯化钠和氯化钙:加入过量碳酸钠溶液,充分反应后,过滤,蒸发 | |
| C. | 除去MgSO4溶液中混有少量的H2SO4:加过量的Mg(OH)2,过滤 | |
| D. | 检验已变质的氢氧化钠是否完全变质:取样,溶解,加入几滴酚酞溶液,观察实验现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
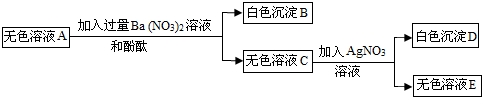
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在100克水里最多能溶解氯化铵50克,因此,氯化铵的溶解度为50克 | |
| B. | 20℃时,100克硫酸钠溶液里含有20克硫酸钠,所以20℃时,硫酸钠的溶解度为20克 | |
| C. | 10℃时,100克水里溶解20克硝酸钾,所以硝酸钾在10℃时的溶解度为20克 | |
| D. | 60℃时,50克水里最多能溶解55克硝酸钾,因此,60℃时硝酸钾的溶解度为ll0克 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 硝酸钾和氯化钠在不同温度下的溶解度如下表所示:
硝酸钾和氯化钠在不同温度下的溶解度如下表所示:| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/克 | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某科学实验小组的同学们在做氯化铁溶液和氢氧化钠溶液反应的实验时,发现一个奇怪的现象:①往装有2~3ml氢氧化钠溶液的试管中滴加几滴氯化铁溶液,发现有红褐色的沉淀,振荡后不消失;②往装有2~3ml氯化铁溶液的试管中滴加几滴氢氧化钠溶液,发现先有少量红褐色的沉淀,振荡后立马消失,请你一起参与以下探究:
某科学实验小组的同学们在做氯化铁溶液和氢氧化钠溶液反应的实验时,发现一个奇怪的现象:①往装有2~3ml氢氧化钠溶液的试管中滴加几滴氯化铁溶液,发现有红褐色的沉淀,振荡后不消失;②往装有2~3ml氯化铁溶液的试管中滴加几滴氢氧化钠溶液,发现先有少量红褐色的沉淀,振荡后立马消失,请你一起参与以下探究: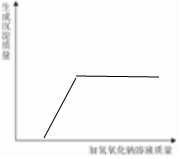 .
.查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com