考点:空气中常见酸碱盐的质量或性质变化及贮存法,实验探究物质的组成成分以及含量,生石灰的性质与用途,碱的化学性质,盐的化学性质,质量守恒定律及其应用,根据化学反应方程式的计算
专题:有关化学方程式的计算,常见的酸 酸的通性,常见的碱 碱的通性,科学探究
分析:(1)依据浓硫酸具有吸水性分析解答;
(2)根据浓硝酸易挥发且光照后易分解分析解答;
(3)根据化学反应前后各原子的种类和个数不变分析解答;
(4)依据氧化钙、氢氧化钙和碳酸钙的性质以及二氧化碳的质量利用反应的方程式即可求出碳酸钙的质量;
解答:解:(1)浓硫酸具有很强的吸水性,所以能够吸收空气中的水蒸气,因此必须密封保存;
(2)浓硝酸具有较强的挥发性且见光易分解,所以一般存于棕色且密封的细口瓶中;
(3)根据SiO
2+2NaOH=X+H
2O可知,反应前含有1个Si原子,4个O原子,2个H原子,2个Na原子,反应后已有2个H原子,1个氧原子,故X中含有2个Na原子,1个Si原子,3个氧原子,故其化学式为Na
2SiO
3;
(4)氧化钙能够和空气中的水反应生成氢氧化钙,其反应的方程式为:CaO+H
2O=Ca(OH)
2,故生石灰需要密封保存;
所以烧杯放热或烧杯壁烫说明检测的物质中含有氧化钙;而滤液中滴加酚酞试液溶液变红,说明溶液中含有能使溶液显碱性的氢氧化钙,但这些氢氧化钙是样品中含有的还是氧化钙反应生成的无法确定,故固体中可能含有氢氧化钙,最后取滤渣滴加盐酸有气泡产生,则能够说明固体中含有碳酸钙,所以检测的样品中一定含有氧化钙、碳酸钙,可能含有氢氧化钙;
解:设样品中碳酸钙的质量为x
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
x 2.2g
=x=10g
样品中碳酸钙的质量分数为:
×100%=80%
故答案为:(1)吸水性;(2)具有挥发性且见光易分解;(3)Na
2SiO
3;(4)CaO+H
2O=Ca(OH)
2;放热或烧杯壁烫;有气泡产生;答:样品中碳酸钙的质量分数为80%.
点评:本题以生活中常见的食品干燥剂为情境角度出发,考查干燥剂是否变质的问题,以实验探究的形式考查了物质的性质,特别是考查学生在实验探究中推断分析能力,和平时对含钙化合物的化学性质的积累!



 教材全解字词句篇系列答案
教材全解字词句篇系列答案
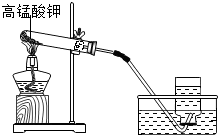 实验室常用高锰酸钾加热制取氧气,装置图如图:
实验室常用高锰酸钾加热制取氧气,装置图如图: