
分析 碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳;
铁锈的主要成分是氧化铁,能和稀硫酸反应生成硫酸铁和水;
氢氧化钠能和二氧化硫反应生成亚硫酸钠和水.
解答 解:(1)碳酸氢钠和稀盐酸反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)氧化铁和稀硫酸反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)氢氧化钠和二氧化硫反应的化学方程式为:2NaOH+SO2═Na2SO3+H2O.
故填:NaHCO3+HCl═NaCl+H2O+CO2↑;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;2NaOH+SO2═Na2SO3+H2O.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:初中化学 来源: 题型:解答题
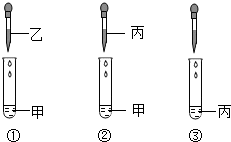 甲、乙、丙、丁都是初中化学中最常见的物质,已知它们由H、O、C、Cl、Na、Ca 6种元素中的2种或3种组成,丙与甲、乙、丁都能发生反应.将这四种物质的溶液按图所示相互滴加,现象为:①产生白色沉淀;②有气泡冒出;③无明显现象
甲、乙、丙、丁都是初中化学中最常见的物质,已知它们由H、O、C、Cl、Na、Ca 6种元素中的2种或3种组成,丙与甲、乙、丁都能发生反应.将这四种物质的溶液按图所示相互滴加,现象为:①产生白色沉淀;②有气泡冒出;③无明显现象查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化铜和硫酸溶液 | B. | Na2CO3溶液和稀盐酸 | ||
| C. | NaOH溶液和稀硫酸 | D. | Ca(OH)2溶液和Na2CO3溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
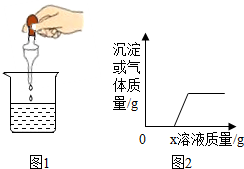 向烧杯中逐渐加入x溶液至过量(图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( )
向烧杯中逐渐加入x溶液至过量(图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( ) | 选项 | A | B | C | D |
| 烧杯中物质 | FeCl3和盐酸 | NaHCO3和NaCl溶液 | 带锈铁钉 | 稀盐酸和硫酸钠 |
| x溶液 | NaOH溶液 | 稀盐酸 | 稀盐酸 | Ba(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
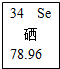 硒可用作静电复印硒鼓的材料.元素周期表中“硒”的信息如图所示.下列有关硒元素的说法错误的是( )
硒可用作静电复印硒鼓的材料.元素周期表中“硒”的信息如图所示.下列有关硒元素的说法错误的是( )| A. | 是非金属元素 | B. | 原子序数为34 | ||
| C. | 元素符号是Se | D. | 相对原子质量为78.96g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
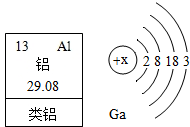 1875年,法国化学家布瓦博德朗公布类铝他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9/cm3-6.0g/cm3之间.
1875年,法国化学家布瓦博德朗公布类铝他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9/cm3-6.0g/cm3之间.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 鼻孔凑到容器口闻药品的气味 | |
| B. | 若没有说明用量,固体只需盖满试管底部 | |
| C. | 用药匙取少量氯化钠,尝一尝味道 | |
| D. | 为了节约药品,实验剩余的药品应放回原瓶 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com