
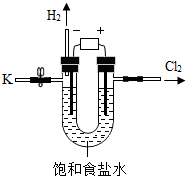
 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
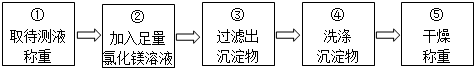
分析 (1)氢氧化钠溶液显碱性,能使酚酞试液变红色;
(2)氢氧化钠与稀盐酸反应生成氯化钠和水;
(3)稀盐酸和氢氧化钠恰好完全反应时,溶液显中性,pH=7;
(4)氢氧化钠和氯化镁反应生成白色沉淀氢氧化镁和氯化钠;
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,则氢氧化镁沉淀上会附着部分杂质.
解答 解:(1)检验含有氢氧化钠的方法是取样,滴加几滴无色酚酞试液,溶液变红色.
故填:取样,滴加几滴无色酚酞试液,溶液变红色.
(2)氢氧化钠与稀盐酸反应的化学方程式为:NaOH+HCl═NaCl+H2O.
故填:NaOH+HCl═NaCl+H2O.
(3)稀盐酸和氢氧化钠恰好完全反应时,溶液显中性,pH=7,当恰好完全反应时消耗稀盐酸的体积为9.8mL.
故填:9.8.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应;
滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,往上层澄清液体中继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量.
故填:使NaOH完全反应;往上层澄清液体中继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量.
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,则氢氧化镁沉淀上会附着部分杂质,导致所测定氢氧化钠的质量分数将偏大.
故填:偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | 在生铁表面有气泡产生 | ||
| C. | 溶液中有黑色固体残留 | D. | 溶液颜色由无色变为黄色 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ,硒单质是红色或灰色粉末,带灰色金属光泽,导电性随光照强度急剧变化,可制半导体和光敏材料.硒在空气中燃烧发出蓝色火焰,生成二氧化硒.工业是可以利用反应Na2SeSO3→Na2SO3+Se来制备硒单质.
,硒单质是红色或灰色粉末,带灰色金属光泽,导电性随光照强度急剧变化,可制半导体和光敏材料.硒在空气中燃烧发出蓝色火焰,生成二氧化硒.工业是可以利用反应Na2SeSO3→Na2SO3+Se来制备硒单质.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 计算需氢氧化钠2g、水50g | |
| B. | 将氢氧化钠固体放于纸上称量 | |
| C. | 把氢氧化钠固体放入量筒中溶解 | |
| D. | 将配好的氢氧化钠溶液装瓶并密封保存 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
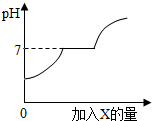 现有盐酸和CaCl2的混合溶液(CaCl2水溶液呈中性),向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
现有盐酸和CaCl2的混合溶液(CaCl2水溶液呈中性),向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )| A. | 水 | B. | 纯碱溶液 | C. | 石灰石 | D. | 石灰水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
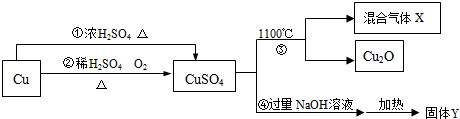
| A. | 途径②比途径①更好地体现绿色化学思想 | |
| B. | 生成等质量的硫酸铜,途径①中消耗硫酸的质量多 | |
| C. | 反应③分解所得混合气体X的成分是SO2和SO3 | |
| D. | 固体Y为CuO |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com