
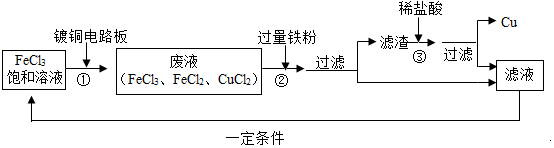
分析 (1)根据过量铁粉能与氯化铁,氯化铜发生化学反应写出反应的化学方程式;
(2)过量铁粉与氯化铜反应,所以滤渣的成份有多余的铁和化学反应生成的铜,过量的铁能与盐酸反应,据此分析回答;
(3)根据流程中发生的反应分析可以循环、回收利用的物质.
解答 解:(1)在②中,过量铁粉能与氯化铁,氯化铜发生化学反应,反应的化学方程式分别是:2FeCl3+Fe═3FeCl2、Fe+CuCl2═FeCl2+Cu;
(2)过量铁粉与氯化铜反应生成了铜和氯化亚铁,所以滤渣的成份有多余的铁和化学反应生成的铜,加入盐酸时,过量的铁能与盐酸反应,反应的化学方程式是:2HCl+Fe═FeCl2+H2↑.
(3)由印刷线路板的生产及废液的处理过程可知,得到的FeCl2溶液经过处理后可形成氯化铁溶液,再用来处理镀铜的电路板,可以循环、回收利用.
故答为:(1)Fe+CuCl2═Cu+FeCl2(或2FeCl3+Fe═3FeCl2);(2)Fe、Cu,Fe+2HCl═FeCl2+H2↑;(3)FeCl2.
点评 熟练利用金属活动性顺序,提纯和回收利用金属;会处理实验流程图.


科目:初中化学 来源: 题型:选择题
| A. | 积极植树、造林、种草,提升绿植覆盖面积 | |
| B. | 工业废水、废渣、废气直接排放 | |
| C. | 建设海绵城市,减少水的流失 | |
| D. | 严格监管化肥和农药的使用 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

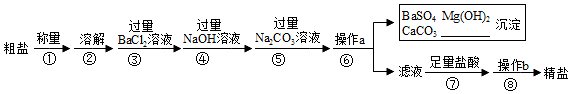
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
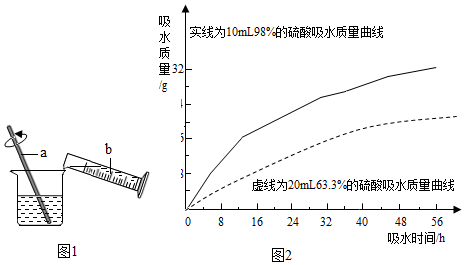
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
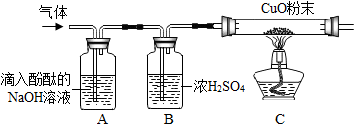
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com