
| A.溶液变浑浊 | B.溶液仍饱和 |
| C.溶液质量不变 | D.溶质质量分数变小 |
科目:初中化学 来源: 题型:
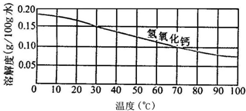
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶 解/g 度 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.187 | 0.178 | 0.165 | 0.153 | 0.141 | 0.129 | 0.116 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2006?长春)据报道:某农民为保鲜吃剩的半个西瓜,将其送入菜窖时因CO2含量过高而导致死亡.某同学看了报道后,决定对自家菜窖内CO2的含量进行探究.
(2006?长春)据报道:某农民为保鲜吃剩的半个西瓜,将其送入菜窖时因CO2含量过高而导致死亡.某同学看了报道后,决定对自家菜窖内CO2的含量进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:
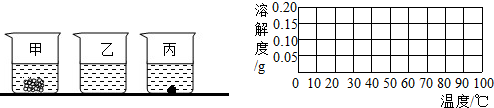
 小刚在化学实验室发现,盛放烧碱固体的试剂瓶瓶口未盖露置在空气中.小刚叫来小军和小红,共同探究这种烧碱的是否变质.为测定其成分,小明称取该烧碱样品3g,充分溶解于水中,再滴加氢氧化钙溶液,产生沉淀的质量与加入氢氧化钙溶液的质量关系如右图所示.求:
小刚在化学实验室发现,盛放烧碱固体的试剂瓶瓶口未盖露置在空气中.小刚叫来小军和小红,共同探究这种烧碱的是否变质.为测定其成分,小明称取该烧碱样品3g,充分溶解于水中,再滴加氢氧化钙溶液,产生沉淀的质量与加入氢氧化钙溶液的质量关系如右图所示.求:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
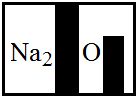 (2013?西华县二模)酸、碱、盐是几类有广泛用途的重要化合物.
(2013?西华县二模)酸、碱、盐是几类有广泛用途的重要化合物.| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 | 白色沉淀全部溶解,并产生大量气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2013?井研县模拟)某初三化学兴趣小组成员在购回的袋装薯片中发现还有一个小袋,上面标有如右图信息.撕开小袋,发现里面的固体粉末有少许是棕红色,大多数是白色的.经过同学们分析讨论,认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe.为了验证自己的判断,他们进行了以下实验探究,请你一同参与.
(2013?井研县模拟)某初三化学兴趣小组成员在购回的袋装薯片中发现还有一个小袋,上面标有如右图信息.撕开小袋,发现里面的固体粉末有少许是棕红色,大多数是白色的.经过同学们分析讨论,认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe.为了验证自己的判断,他们进行了以下实验探究,请你一同参与.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com