
分析 酸的化学性质主要包括以下几点:能使指示剂变色、能与活泼金属反应、能与金属氧化物反应、能与碱反应、能与某些盐反应;化学方程式的书写主要做好以下几个方面:反应物、生成物、反应条件、化学式的书写、配平、沉淀气体的标注等.化学反应都遵循质量守恒定律.
解答 解:带有铁锈的铁片含有两种物质:铁锈(主要成分是Fe2O3)属于金属氧化物与酸反应生成盐和水、铁属于活泼金属与酸发生置换反应生成盐和氢气;铜属于不活泼金属与稀酸不反应,但与浓硫酸反应;根据质量守恒定律反应前后原子的种类、个数都不变.
故答案为:Fe2O3+3H2SO4=Fe2 (SO4) 3+3H2O;Fe+H2SO4=FeSO4+H2↑;SO2
点评 此题重点考查了酸的化学性质、有关化学方程式的书写和质量守恒定律的内容.


 53天天练系列答案
53天天练系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 购物尽量用塑料袋,少用布袋 | B. | 使用节能灯泡,做到人走灯灭 | ||
| C. | 少开私家车,多乘公交车 | D. | 节约用水,关紧水龙头 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
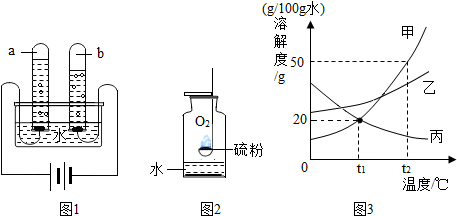
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
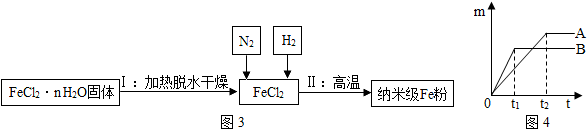
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com