
分析 根据题干提供的信息进行分析解答,①将固体混合物溶于水后得无色透明澄清溶液A,硫酸铜溶液是蓝色的,碳酸钙是不溶于水的物质;
②向A中加入足量BaCl2溶液完全反应后,过滤,得白色沉淀X和澄清溶液B,氯化钡能与硫酸钠反应生成硫酸钡沉淀;
③白色沉淀X中加入足量盐酸,沉淀不消失,硫酸钡不溶于酸;
④澄清溶液B中,加入氢氧化钠溶液并微热,有刺激性气味的气体Y放出,说明含有铵根离子.
据此解答.
解答 解:①将固体混合物溶于水后得无色透明澄清溶液A,硫酸铜溶液是蓝色的,碳酸钙是不溶于水的物质,说明固体这一定不含有硫酸铜和碳酸钙;
②向A中加入足量BaCl2溶液完全反应后,过滤,得白色沉淀X和澄清溶液B,氯化钡能与硫酸钠反应生成硫酸钡沉淀,说明一定含有硫酸钠;
③白色沉淀X中加入足量盐酸,沉淀不消失,硫酸钡不溶于酸;
④澄清溶液B中,加入氢氧化钠溶液并微热,有刺激性气味的气体Y放出,说明含有铵根离子,一定含有硝酸铵.
(1)X是硫酸钡,Y是氨气,故填:BaSO4,NH3;
(2)原混合物一定含有的物质是Na2SO4、NH4NO3,一定不含有的物质是CuSO4、CaCO3,可能含有的物质是NaCl.故填:Na2SO4、NH4NO3;CuSO4、CaCO3;NaCl;
(3)氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,硝酸铵能与氢氧化钠反应生成硝酸钠、氨气和水,都属于复分解反应,故填:Na2SO4+BaCl2═BaSO4↓+2NaCl,NH4NO3+NaOH=NaNO3+NH3↑+H2O,复分解反应.
点评 在解此类题时,首先分析题中的现象物质之间的关系,然后根据现象推出可以确定存在或不存在的物质,对于现象不能确定的只能再设计实验进行验证.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
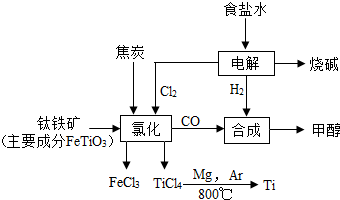 钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇(CH4O)厂组成产业链可以大大提高资源利用率,减少环境污染.
钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇(CH4O)厂组成产业链可以大大提高资源利用率,减少环境污染.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水分子运动速率加快 | B. | 水分子之间的间隔变大 | ||
| C. | 水分子的数目增多了 | D. | 水分子的结构没有改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 稀有气体可做保护气,因为原子最外层电子层达到稳定结构 | |
| B. | 水和过氧化氢的化学性质不同,因为组成元素和分子构成不同 | |
| C. | NaOH溶于水温度升高,因为Na+、OH-扩散吸收的热量大于水合放出的热量 | |
| D. | 水通电生成氢气和氧气,因为水分子中含有氢分子和氧分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 有机物:石墨、酒精、葡萄糖 | B. | 氧化物:水、氯化铁、五氧化二磷 | ||
| C. | 盐|碳酸钙、纯碱、氯化铵 | D. | 单质:金刚石、氨气、红磷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com