
 某化学兴趣小组为探究“氢氧化钠溶液与盐酸发生中和反应时溶液温度的变化情况”,进行了如下实验:
某化学兴趣小组为探究“氢氧化钠溶液与盐酸发生中和反应时溶液温度的变化情况”,进行了如下实验:分析 实验一:(1)根据溶质质量=溶液质量×溶质质量分数;(2)配置该溶液所需要的仪器有:烧杯、量筒、胶头滴管和玻璃棒
实验二:(1)根据△t1时,所加盐酸体积为0,说明中和反应还没有进行,溶液温度还是零度进行分析;
(2)根据图中所给溶液的温度变化随加入盐酸的体积变化的不同数值可以先描出各个点,再连接各点成线即可完成解答;
(3)根据加入盐酸的量在0-10mL之间时,从中和反应放出热量进行分析;
(4)根据所加盐酸的质量分数是原来的2倍,所以相同体积是所含溶质是原来的2倍,这样反应后混合溶液的质量就没有原来的多进行分析
解答 解:实验一:(1)氢氧化钠的质量为50g×10%=5g;
(2)配置该溶液所需要的仪器有:烧杯、量筒、胶头滴管和玻璃棒
实验二:
(1)反应物是盐酸和氢氧化钠,生成物是氯化钠和水,所以方程式是:NaOH+HCl=NaCl+H2O
(2)△t1时,所加盐酸体积为0,说明中和反应还没有进行,溶液温度还是零度,所以表中△t1的值为0;
(3)根据图表中的数据可以对所给数据进行描点连线可以得出液的温度变化(△t)与加入的盐酸体积(V)之间的关系曲线图,所以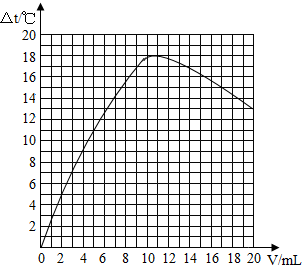
(4)加入盐酸的量在0-10mL之间时,中和反应放出热量,所以加入盐酸的体积在0~10mL时,溶液温度变化的趋势及其原因是:随着中和反应的进行,由于反应放热,溶液温度上升;
(5)所加盐酸的质量分数是原来的2倍,所以相同体积是所含溶质是原来的2倍,这样反应后混合溶液的质量就没有原来的多,所以
横坐标及猜想理由:5,当恰好完全反应时,放出热量的最大值与原实验相同,此时所需20%的盐酸的体积是原来的二分之一;
纵坐标及猜想理由:大于18.2的值,当恰好完全反应时,放出热量的最大值与原实验相同,此时实验总质量比原实验小,所以△t最大值大于18.2℃.
故答案为:实验一:(1)5;(2)玻璃棒
实验二:(1)NaOH+HCl=NaCl+H2O
(2)0;
(3)
(4)随着中和反应的进行,由于反应放热,溶液温度上升;
(5)横坐标及猜想理由:5,当恰好完全反应时,放出热量的最大值与原实验相同,此时所需20%的盐酸的体积是原来的二分之一;
纵坐标及猜想理由:大于18.2的值,当恰好完全反应时,放出热量的最大值与原实验相同,此时实验总质量比原实验小,所以△t最大值大于18.
点评 熟练掌握中和反应的概念及其应用;了解物质发生化学变化时的能量变化:中和放热;解答此类题的关键是正确从材料中抽取信息,准确做出判断,结合已有的知识储备并做出合理的解释


科目:初中化学 来源: 题型:解答题
 实验室中利用CO还原氧化铜的到铜.①写出反应的化学方程式,并利用方程式计算理论上需要一氧化碳的质量是多少克?其物质的量又是多少?
实验室中利用CO还原氧化铜的到铜.①写出反应的化学方程式,并利用方程式计算理论上需要一氧化碳的质量是多少克?其物质的量又是多少?查看答案和解析>>
科目:初中化学 来源: 题型:填空题
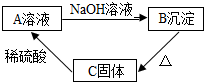 材料:难溶于水的碱在加热的条件下,容易分解生成对应的金属氧化物和水.A、B、C是初中化学中常见的化合物,A溶液呈蓝色,C是一种黑色金属氧化物,A、B、C的转化关系如图所示,请回答下列问题
材料:难溶于水的碱在加热的条件下,容易分解生成对应的金属氧化物和水.A、B、C是初中化学中常见的化合物,A溶液呈蓝色,C是一种黑色金属氧化物,A、B、C的转化关系如图所示,请回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).
A、B、C、D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 工厂排放的废气 | B. | 汽车发动机排放的尾气 | ||
| C. | 燃放烟花爆竹产生的刺激性气体 | D. | 电饭锅煮饭排出的“白汽” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com