40g质量分数为36.5%的盐酸与25g大理石恰好完全反应(大理石中的杂质不参加反应)
(1)生成二氧化碳的质量为多少克.
(2)计算该大理石中碳酸钙的质量分数.
(3)将40g质量分数为36.5%的盐酸稀释为质量分数为10%的盐酸,需要水的质量是多少?
解:40g质量分数为36.5%的盐酸中氯化氢的质量为:40g×36.5%=14.6g
设生成二氧化碳质量为x,25g大理石中碳酸钙的质量为y.
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 73 44
y 14.6g x

解得:x=8.8g y=20g
(2)大理石中碳酸钙的质量分数为:
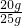
×100%=80%;
(3)设稀释后盐酸溶液的质量为z,根据溶液稀释前后溶质的质量不变可得:
40g×36.5%=z×10%
z=146g
需要水的质量=146g-40g=106g;
答:(1)生成二氧化碳质量为8.8克;
(2)大理石中碳酸钙的质量分数为80%;
(3)需要水的质量是106g.
分析:(1)根据稀盐酸中溶质的质量结合化学方程式可以求算出生成二氧化碳的质量;
(2)根据稀盐酸中溶质的质量结合化学方程式可以求算出大理石中碳酸钙的质量,然后根据物质的质量分数的计算公式即可求出碳酸钙的质量分数;
(3)根据溶液稀释前后溶质的质量不变来解答该题.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.


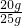 ×100%=80%;
×100%=80%;
