
【题目】A、B、C三种固体物质的溶解度曲线如图所示,请回答:当A中混有少量B时,可采用___________方法提纯A物质。t2°C时,将75 g A的饱和溶液稀释为20%的溶液,需加水的质量为____g。t2°C时,将A、B、C三种物质的饱和溶液降温至t1 °C,所得溶液溶质的质量分数由大到小的顺序为__。
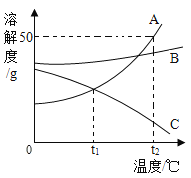
【答案】降温结晶(或冷却热饱和溶液) 50 B>A>C
【解析】
A、B、C三种固体物质的溶解度曲线如图所示,A的溶解度受温度影响较大,且随温度升高而增大,B的溶解度受温度影响较小,当A中混有少量B时,可采用降温结晶(或冷却热饱和溶液)的方法提纯A物质。![]() ,t2°C时,A的溶解度为50g,75 g A的饱和溶液中溶质的质量为:
,t2°C时,A的溶解度为50g,75 g A的饱和溶液中溶质的质量为:![]() ;
;
稀释为20%的溶液,所得溶液的质量为:![]() 需加水的质量为125g-75g=50g;
需加水的质量为125g-75g=50g;
t2℃时,将A、B、C三种物质的饱和溶液降温至t1 °C,A、B的溶解度减小,析出晶体,得t1℃的饱和溶液。![]() ,但是t1℃时,B的溶解度比A的大,所得溶液溶质的质量分数:B>A,降温时,C的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t2℃时饱和溶液溶质的质量分数,C在t2℃时的溶解度比A在t1℃时的溶解度小,所得溶液中溶质质量分数A>C,降温到t1℃三种物质所得溶液溶质的质量分数大小关系是B>A>C。
,但是t1℃时,B的溶解度比A的大,所得溶液溶质的质量分数:B>A,降温时,C的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t2℃时饱和溶液溶质的质量分数,C在t2℃时的溶解度比A在t1℃时的溶解度小,所得溶液中溶质质量分数A>C,降温到t1℃三种物质所得溶液溶质的质量分数大小关系是B>A>C。


科目:初中化学 来源: 题型:
【题目】在“新型冠状病毒”的疫情防控过程中,公共场所常用84消毒液进行消毒。但84消毒液和洁厕灵同时使用,则会发生如图所示的化学反应。下列说法正确的是( )

A.该反应前后各元素化合价不变B.生成的有毒气体是ClO
C.该反应中属于氧化物的有2种D.84消毒液的主要成分是一种盐
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图,下列叙述正确的是( )
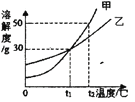
A. t2℃时,甲的溶解度为50
B. 乙中含有少量甲,可用蒸发溶剂的方法提纯甲
C. t2℃时,将甲、乙饱和溶液降温到tl℃,所得溶液中溶质的质量分数相等
D. ti℃时,等质量的甲、乙饱和溶液,升温到t2℃,分别加入20 g的甲、乙,一定可以得到甲、乙的饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体(不含结晶水)的溶解度曲线如图所示。下列说法正确的是
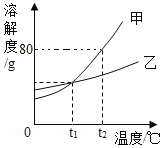
A. t1℃时,甲、乙饱和溶液溶质的质量分数相等
B. 乙中含有少量甲时,可用降温结晶法提纯乙
C. t2℃时,将50g甲加入50g水中,可得到100g溶液
D. t2℃时的甲、乙饱和溶液分别降温到t1℃时,析出晶体的质量甲大于乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质,它们可能是镁、CuSO4溶液、NaOH溶液和Ba(NO3)2溶液,甲与乙反应生成白色沉淀,甲与丙反应生成蓝色沉淀,甲与丁混合有红色固体产生,请回答:
(1)丁是_____,甲与丁反应类型为_____。
(2)甲与乙反应的化学方程式为_____。
(3)丁与CO2在点燃条件下发生的反应和甲与丁反应的类型相同,写出此反应的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包由KCl、MgSO4和CaCl2组成的固体混合物,为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计如下实验方案:

(1)M溶液中的溶质是什么?_____。
(2)请设计实验证明滤液Ⅱ中除KCl外的其他溶质。(写出实验步骤和现象)_____。
(3)最后所得KCl的质量大于原固体中KCl的质量,写出一个可使KCl质量增加的化学方程式。_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】盐酸是重要化工产品。
(1)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式_____。
(2)盐酸具有挥发性,在空气中打开盛有浓盐酸的试剂瓶瓶盖,在瓶口处观察到的现象是_____。
(3)氨水也具有挥发性,可挥发出氨气。如下图,在a、b处放有浸泡过浓盐酸或浓氨水的棉花,过一会在c处可观察到的现象是_____,a处是放有浸泡过_____的棉花。(已知:①NH3与HCl在空气中相遇可反应生成白色固体NH4Cl;②相对分子质量越小的气体扩散速度越快)
![]()
(4)实验室可用NH4Cl与Ca(OH)2固体加热发生复分解反应制取NH3,请写出此反应的化学方程式_____,收集NH3可用向_____排空气法。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对某铜锌合金样品进行探究实验。称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示。求:
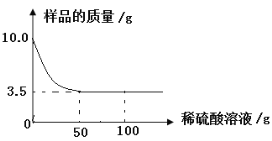
(1)铜锌合金汇中,Zn的质量分数是 。
(2)所用稀硫酸溶液中溶质的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计的工业制备氢氧化钠的流程如图。
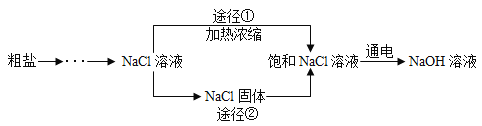
资料:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+Cl2↑,两电极,一端得到NaOH和H2,另一端得到Cl2。
(1)晾晒海水得到粗盐的原理是_______________。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、酒精灯、蒸发皿和_________。
(3)工业生产中应选择途径__________(“①”或“②”),理由是__________。
(4)Cl2可用于生产84消毒液(有效成分NaClO),反应原理为Cl2+2NaOH=NaClO+NaCl+H2O,反应前后氯元素的化合价有________种。
(5)电解水的实验可测定水的组成,不能加入NaCl增强水的导电性的理由是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com