
【题目】溶液的微粒构成决定其性质,溶液的宏观组成是其成分计算的依据。
(1)氯化钠晶体是由 (填微粒符号)构成的。氯化钠溶于水,溶液导电能力显著增强,是因为其溶液中含有 ; 氯化钠溶液通电后生成氢氧化钠、氯气和氢气,请写出该化学反应方程式 。
(2)用溶质质量分数为15%的氯化钠溶液来配制500g溶质质量分数为6%的氯化钠溶液,需要15%的氯化钠溶液 g,加水 g。
(3)某温度下饱和氯化钠溶液的溶质质量分数为26%,试列式计算该温度下氯化钠的溶解度S(计算结果保留小数点后一位)。
【答案】(1)Na+、Cl-;自由移动的钠离子和氯离子NaCl![]() NaOH +Cl2↑ +H2↑(2)200克;300克(3)35.1克。
NaOH +Cl2↑ +H2↑(2)200克;300克(3)35.1克。
【解析】
试题分析:氯化钠晶体是由Na+、Cl-两种离子构成的。氯化钠溶于水,溶液导电能力显著增强,是因为其溶液中含有自由移动的钠离子和氯离子; 氯化钠溶液通电后生成氢氧化钠、氯气和氢气,该化学反应方程式2NaCl +2H2O![]() 2NaOH +Cl2↑ +H2↑。用溶质质量分数为15%的氯化钠溶液来配制500g溶质质量分数为6%的氯化钠溶液,需要15%的氯化钠溶液=500g*6%÷15%=200g,加水的量=500克-200克=300克。设该温度下氯化钠的溶解度S克,则S克/(S克+100克)×100%=26%,则S=35.1克。
2NaOH +Cl2↑ +H2↑。用溶质质量分数为15%的氯化钠溶液来配制500g溶质质量分数为6%的氯化钠溶液,需要15%的氯化钠溶液=500g*6%÷15%=200g,加水的量=500克-200克=300克。设该温度下氯化钠的溶解度S克,则S克/(S克+100克)×100%=26%,则S=35.1克。


科目:初中化学 来源: 题型:
【题目】水是最重要的物质之一.下列有关水的说法正确的是( )
A.水是一种常用溶剂
B.蒸馏水是一种硬水
C.雨水的pH一定为7
D.纯净水不含任何化学物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3。
电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:
![]()
其中电石与水反应生成氢氧化钙和乙炔,该反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑ 残渣中主要成分是Ca(OH)2 和CaCO3。
Ⅰ.制备KClO3的流程如下:
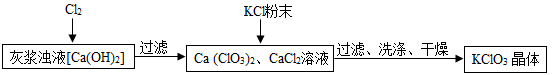
(1)向灰浆浊液中通入Cl2 ,得到Ca(ClO3)2、CaCl2溶液。反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5。写出此反应的化学方程式 。
(2)有关物质在常温下的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入KCl粉末,KCl与 (填化学式)发生了复分解反应,得到KClO3晶体。你认为能得到KClO3 晶体的原因是 。
(3)洗涤时,可以选用下列 作洗涤剂(填字母编号)。
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
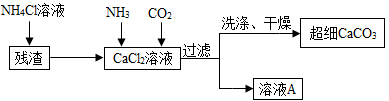
(4)流程中溶液A可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Ⅰ.科学家经过多年研究证明,很多同学爱吃的某些小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺,丙烯酰胺的化学式为C3H5ON。回答下列问题:
(1)每个丙烯酰胺分子中有__ _个原子。
(2)丙烯酰胺中碳元素的质量分数是__ __(保留一位小数)。
Ⅱ.近来有科学家提出利用“碳捕捉技术”来降低工业生产中二氧化碳的排放量。“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用足量的NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。
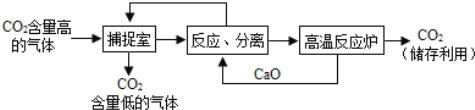
(1)捕捉室中发生反应的化学方程式为: ;
(2)把CaO放入反应分离室中与H2O反应,请写出该反应的化学方程式: ;利用此反应,氧化钙可用作食品 剂;
(3)“反应分离”中为将固体和液体分离,所用到的基本操作是 ,该固体是碳酸钙。
(4)整个过程中,可以循环利用的物质是 和 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活
(1)化石燃料之一天然气,主要成分是甲烷,甲烷燃烧的化学方程式为
(2)旅游时,多数人喜欢携带轻便耐摔的塑料瓶,塑料属于 (填序号)。
①合成材料 ②金属材料③复合材料
(3)均衡的营养需要合理膳食。食品中的有机营养素有糖类、脂肪、蛋白质、维生素,食用水果蔬菜为人体补充的主要有机营养素是 。
(4)人体若缺乏维生素C易患 (填序号)。①甲状腺肿大 ②坏血病 ③夜盲症
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com