
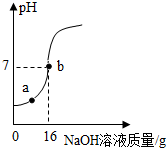
 小明在老师的指导下粗略测量一瓶稀氢氧化钠溶液的溶质质量分数,向9.8g克10%的稀硫酸中逐滴滴入未知浓度稀氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图象如图.
小明在老师的指导下粗略测量一瓶稀氢氧化钠溶液的溶质质量分数,向9.8g克10%的稀硫酸中逐滴滴入未知浓度稀氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图象如图.分析 根据氢氧化钠和硫酸反应生成硫酸钠和水,然后依据题中所给的数据继续计算.
解答 解:(1)设参加反应的氢氧化钠质量为x,生成硫酸钠质量为y
2NaOH+H2SO4=Na2SO4+2H2O
80 98 142
x 9.8g×10% y
$\frac{80}{x}$=$\frac{98}{9.8g×10%}$=$\frac{142}{y}$
x=0.8g
y=1.42g
所以稀氢氧化钠溶液的溶质质量分数为:$\frac{0.8g}{16g}$×100%=5%,
b点时溶液中溶质的质量分数为:$\frac{1.42g}{16g+9.8g}$×100%=5.5%;
(2)氢氧化钠和硫酸在b点完全反应,所以a点时,硫酸过量,在a点的溶液中的离子有Na+、H+、S${{O}_{4}}^{2-}$.
故答案为:(1)5%,5.5%;
(2)Na+、H+、S${{O}_{4}}^{2-}$.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性.


科目:初中化学 来源: 题型:解答题
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小林的猜想正确. |
| ②无现象,溶液呈红色. | 小红的猜想正确. | |
| ③有白色沉淀,溶液呈无色. | 小云的猜想正确. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁矿石在地壳中含量丰富,可以随意开采 | |
| B. | 废弃铁制品再利用的成本太高,属于不可回收垃圾 | |
| C. | 为防止铁制品生锈,可在其表面涂上一层油漆 | |
| D. | 钢的含碳量比生铁的高,所以钢的性能比生铁优越 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生活中和工业上用的盐通常都为NaCl | |
| B. | 氯化钠溶液中混有少量硝酸钾杂质,可以用冷却热饱和溶液的方法提纯食盐 | |
| C. | 我们获得NaCl的主要来源是用烧碱和盐酸反应制得 | |
| D. | 鉴别NaCl溶液和Na2CO3溶液可以用稀盐酸溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4、NaCl、NaOH三者溶液的pH逐渐变小 | |
| B. | 黄铜的硬度比纯铜大 | |
| C. | 同温等质量的KNO3、NaCl、CaO固体三者放入100g水中后,所得溶液的浓度逐渐降低 | |
| D. | K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
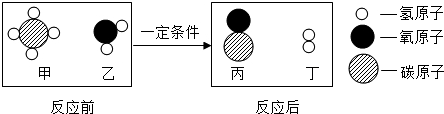
| A. | 反应前后各元素的化合价均不变 | B. | 反应前后分子总数不变 | ||
| C. | 反应前后原子数目发生了变化 | D. | 反应物和生成物中都有氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com