
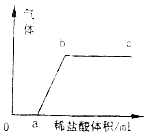
 已知往碳酸钠溶液逐滴滴入稀盐酸会依次发生以下两个反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑.现有一包由氢氧化钠和碳酸钠组成的固体粉末,将该粉末加入足量水中充分溶解,往所得溶液中逐滴滴入稀盐酸,产生气体与所加稀盐酸有如图所示的关系.根据以上所述现象回答:
已知往碳酸钠溶液逐滴滴入稀盐酸会依次发生以下两个反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑.现有一包由氢氧化钠和碳酸钠组成的固体粉末,将该粉末加入足量水中充分溶解,往所得溶液中逐滴滴入稀盐酸,产生气体与所加稀盐酸有如图所示的关系.根据以上所述现象回答:科目:初中化学 来源: 题型:选择题
| 溶质 | 碘 | 高锰酸钾 | |||
| 溶剂 | 水 | 汽油 | 酒精 | 水 | 汽油 |
| 溶解性 | 不溶 | 易溶 | 可溶 | 易溶 | 不溶 |
| A. | 水、汽油、酒精都可以作溶剂 | |
| B. | 溶液都是均一、稳定、无色的混合物 | |
| C. | 同一物质在不同溶剂中的溶解性不同 | |
| D. | 衣服上不慎沾上碘酒,可用汽油擦洗 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 泡沫塑料、海绵是可燃物 | |
| B. | 泡沫塑料、海绵的着火点很高 | |
| C. | 燃烧产生的浓烟中含有大量有毒气体 | |
| D. | 着火时应尽快湿布捂住口鼻,撤向安全处 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Al3+--铝元素的化合价为+3 | |
| B. | 3H2O--3个水分子 | |
| C. | 3H--3个氢原子 | |
| D. | SO3--1个三氧化硫分子中含有3个氧原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
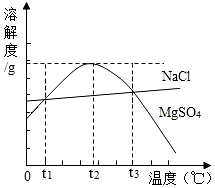 如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )
如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( )| A. | 只有在t1℃时,NaCl和MgSO4的溶解度才相等 | |
| B. | MgSO4的饱和溶液在t2℃时,溶质的质量分数最大 | |
| C. | t1℃~t3℃,MgSO4的溶解度随温度升高而增大 | |
| D. | t3℃时的MgSO4饱和溶液降温至t2℃时,有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | A 测溶液pH | B滴加Na2CO3溶液 | C滴加BaCl2溶液 |
| 实验操作 | 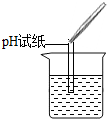 | 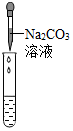 | 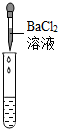 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液显酸性 | 溶液中有H2SO4剩余 | 溶液中有H2SO4剩余 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com