

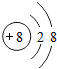 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.分析 (1)根据地壳中含量最多的元素为氧元素,处于第2周期,故可知其位置进行解答;
(2)根据14号元素为硅元素以及光导纤维的成分是二氧化硅进行解答;
(3)根据金属单质越易与水反应,金属的活动性就越强进行解答;
(4)先推测17号和12号元素种类,再利用化学式的书写原则正确书写化学式
解答 解:(1)地壳中含量最多的元素为氧元素,处于第2周期,故可知其位置在B处,氧原子最外层电子数为6,容易得到2个电子,形成稳定结构,所以其原子形成的稳定结构的微粒示意图为 ;该微粒的表示符号为O2-;
;该微粒的表示符号为O2-;
(2)14号元素为硅元素,其中光导纤维的成分是二氧化硅,所以硅和氧气反应生成二氧化硅,该化学反应方程式是:O2+Si$\frac{\underline{\;高温\;}}{\;}$SiO2;
(3)金属单质越易与水反应,金属的活动性就越强,11号元素金属单质与冷水剧烈反应,l2号元素金属单质与热水缓慢反应,13号元素金属单质投入热水中无明显现象,则金属单质的活动性最强的是11号元素,最弱的是13号元素;
(4)17号元素为氯元素,化合价为-1价,12号元素为镁元素,化合价为+2价,所以形成的化合物化学式为MgCl2.
故答案为:(1)B;二; ;O2-;(2)O2+Si$\frac{\underline{\;高温\;}}{\;}$SiO2;(3)11;l3;(4)MgCl2.
;O2-;(2)O2+Si$\frac{\underline{\;高温\;}}{\;}$SiO2;(3)11;l3;(4)MgCl2.
点评 了解元素周期表的特点及其应用;核外电子在化学反应中的作用;了解元素的简单分类;了解原子结构示意图与离子结构示意图的特点.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
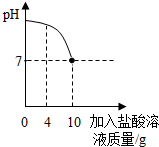 实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液.然后往烧杯中滴加该盐酸.反应过程中溶液的pH与滴入盐酸的质量关系如图.请回答下列问题:
实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液.然后往烧杯中滴加该盐酸.反应过程中溶液的pH与滴入盐酸的质量关系如图.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
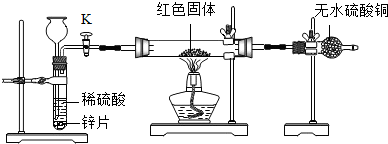
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 可能存在氢氧化钠 | B. | 可能存在硫酸钠 | ||
| C. | 肯定不存在氯化钡 | D. | 肯定只存在碳酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
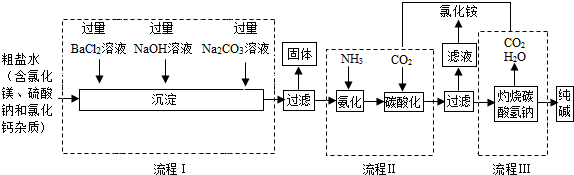
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com