19.铜及其化合物在生产、生活中都有广泛的应用.
一、铜的性质及其应用
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿).铜绿化学式是Cu
2(OH)
2CO
3,它受热会分解生成三种氧化物.
(1)青铜器属于A(填序号).
A.无机材料 B.合成材料 C.复合材料 D.复合肥
(2)铜绿分解的化学方程式为Cu
2(OH)
2CO
3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H
2O+CO
2↑.
(3)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如图1所示(所用铜片洁净、光亮,试管内的“

”为铜片).
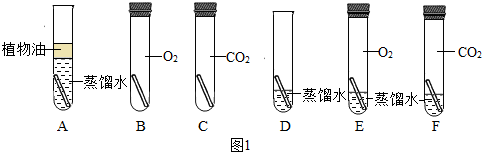
实验较长时间后,发现D(填试管编号)试管中铜片最先生锈.小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验.你认为要补充的一个实验是:Cu和CO
2、O
2(写出试管中需要的物质).可以省略不做的实验是试管ABC(填试管编号).
二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu
2S+O
2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO
2方法二:湿法炼铜:CuSO
4+Fe=FeSO
4+Cu
(4)上述两种方法中,你认为哪种方法更好方法二 ,原因是能耗低(写出1条原因即可).辉铜矿的主要成分为Cu
2S,常用于火法炼铜.若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu
2S 80%的辉铜矿111 t(取整数).
三、铜的化合物的制备研究
碱式碳酸铜可用于生产木材防腐剂等.工业上可用微蚀刻废液(含有一定量Cu
2+、H
+、SO
42-、H
2O
2和微量Fe
3+)制备高纯度碱式碳酸铜,其制备过程如图2:
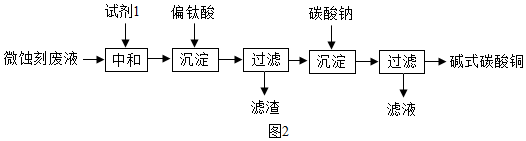
(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用c(填序号).
a.Fe
2O
3 b. CaCO
3 c.CuO
(6)加入Na
2CO
3沉淀前须除去Fe
3+,否则Fe
2(SO
4)
3会与Na
2CO
3反应,产生一种气体,同时生成NaFe
3(OH)
6(SO
4)
2沉淀,影响产品质量,6Na
2CO
3+3Fe
2(SO
4)
3+6H
2O
=2NaFe
3(OH)
6(SO
4)
2+6CO
2↑+5Na
2SO
4.
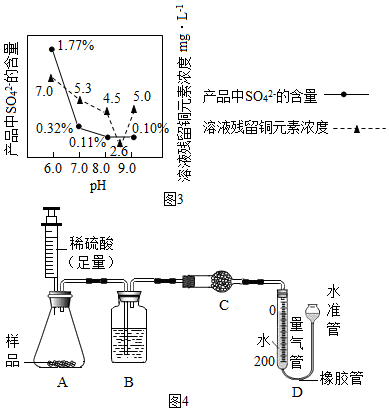
(7)加入Na
2CO
3沉淀时,反应液pH对产品中的SO
42-含量以及反应液中Cu
2+沉淀效率的影响如图3所示,第二次沉淀时溶液pH最好控制在8.5.
(8)所制得的碱式碳酸铜的组成可表示为:xCuCO
3•yCu(OH)
2•zH
2O.某研究小组设计如图4实验装置测定其中CuCO
3的质量分数(不考虑植物油中溶解CO
2产生的影响).
实验步骤如下:①连接装置并检查装置气密性;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10ml;④向锥形瓶内加入50ml(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml.
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是干燥二氧化碳,少量植物油的作用是防止二氧化碳溶于水,C中的试剂是c(填字母序号); a.碱石灰 b.浓硫酸 c.无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管缓慢下移(填“缓慢上移”或“缓慢下移”).
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L.根据实验数据计算产品中CuCO
3的质量分数(写出计算过程).(保留到0.1%)
Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是BCD(填字母序号);
A.步骤③中平视刻度,步骤⑥中仰视读数
B.硫酸的用量不足
C.量气管中未加植物油
D.步骤⑥中没有调节量气装置两边液面相平,直接读数
(9)碱式碳酸铜【xCuCO
3•yCu(OH)
2•zH
2O】的热分解研究.小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如图5.
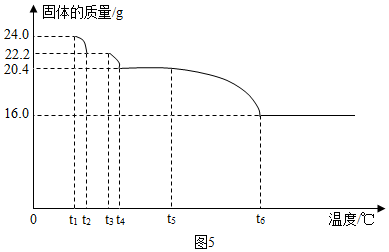
(已知Cu(OH)
2的分解温度小于CuCO
3的分解温度.)
Ⅰ.通过计算可得x:y:z=1:1:1;
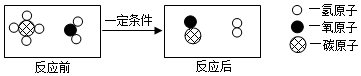
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu
2O+O
2↑.





 ”为铜片).
”为铜片).