


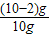 ×100%=80%
×100%=80%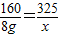 ,x═16.25g
,x═16.25g 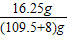 ×100%═13.8%
×100%═13.8%

科目:初中化学 来源: 题型:阅读理解
| 验证 | 对比实验 | |
| 假设1 | 示例:加热烧杯,烧杯不可燃 | (仿照示例填写 ) 点燃蜡烛,蜡烛可燃; 点燃蜡烛,蜡烛可燃; |
| 假设2 | 常温放置蜡烛不燃烧 | (仿照示例填写) 点燃蜡烛,蜡烛燃烧; 点燃蜡烛,蜡烛燃烧; |
| 假设3 | 点燃蜡烛,蜡烛在空气中持续燃烧 | (仿照示例填写 ) 将燃着的蜡烛扣入一只烧杯内,蜡烛逐渐熄灭. 将燃着的蜡烛扣入一只烧杯内,蜡烛逐渐熄灭. |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2009?南京)从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答-下列问题:
(2009?南京)从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答-下列问题:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com