19.碱式碳酸镁[Mg
2(OH)
2CO
3]和过氧化镁(MgO
2)都是重要化工原料.
Ⅰ.以Mg
2(OH)
2CO
3为原料,制备产品MgO
2的步骤如下:
(1)煅烧:煅烧Mg
2(OH)
2CO
3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为Mg
2(OH)
2CO
3 $\frac{\underline{\;高温\;}}{\;}$2MgO+H
2O+CO
2↑.
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H
2O
2=MgO
2+H
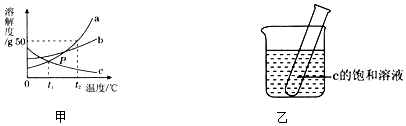
2O,温度升高,说明该反应放出热量(填“放出”或“吸收”).其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO
2产率(产率=$\frac{产品的实际质量}{产品的理论质量}$×100%)的影响分别如图1所示,则最佳的煅烧温度为650℃、煅烧时间为2小时.
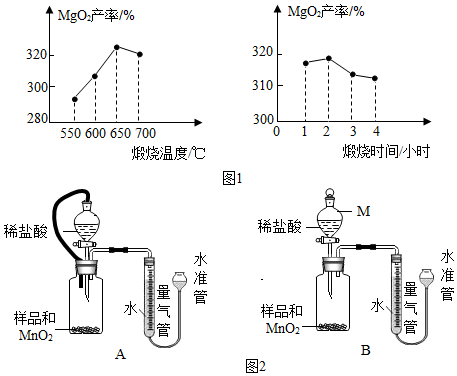
(3)分离:得到产品.
(4)测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O
2体积,计算MgO
2的质量分数.
已知:a.MnO
2与稀盐酸不反应 b.MgO
2+2HCl=MgCl
2+H
2O
2 c.2MgO
2$\frac{\underline{\;加热\;}}{\;}$2MgO+O
2↑ d.MgO+C$\frac{\underline{\;高温\;}}{\;}$Mg+CO↑
①仪器M的名称是分液漏斗,MnO
2的作用是催化剂.
②相同条件下,装置A能使测定结果更准确.(填图2中“装置A”或“装置B”)
③实验室用溶质质量分数为37%、密度是1.18g•mL
-1的浓盐酸配制10%的稀盐酸110g,需要水80.3mL.(水的密度是1g•mL
-1,计算结果保留一位小数)
④经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO
2质量分数的是a.(填序号)
a.加热,使MgO
2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)
2质量
Ⅱ.MgCl
2是制备Mg
2(OH)
2CO
3的原料,现用含碳酸镁84%的菱镁矿制备MgCl
2,反应如下:MgCO
3+Cl
2+CO$\frac{\underline{\;高温\;}}{\;}$MgCl
2+2CO
2(设杂质不参加反应).生产19吨MgCl
2需要这样的菱镁矿多少吨?(写出计算过程)

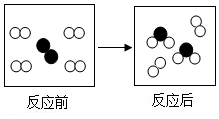 如图是某个化学反应的微观示意图,图中“〇”、“●”表示不同元素的原子.从图中获得的有关信息不正确的是( )
如图是某个化学反应的微观示意图,图中“〇”、“●”表示不同元素的原子.从图中获得的有关信息不正确的是( )
 合理利用化学知识,生活更科学、更美好.
合理利用化学知识,生活更科学、更美好.