
分析 (1)根据溶液的形成以及化学方程式的书写方法来分析;
(2)根据溶液的组成、特征、酸碱度的测定方法来分析;
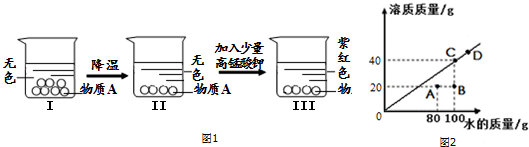
根据溶解度曲线以及图象信息来分析;
(3)根据溶液的用途来分析.
解答 解:(1)①食盐和蔗糖都能溶于水,形成溶液,而花生油不溶于水,不能形成溶液,故选:C;
②生石灰是氧化钙的俗称,与水反应生成氢氧化钙,化学方程式为:CaO+H2O═Ca(OH)2;
(2)①A、盐酸是氯化氢气体和水的混合物,故A错误;
B、溶液具有均一性和稳定性,故B正确;
C、石蕊试液只能测定出溶液的酸碱性,无法测定酸碱度,测定溶液的酸碱度可用pH试纸,故C错误;
D、饱和溶液不一定是浓溶液,如饱和的氢氧化钙溶液就是稀溶液,故D正确.
故选:BD;
②a、由图象可知,温度降低烧杯中未溶解的固体溶质减少了,说明该物质的溶解度随着温度的升高而减小;
b、该物质的饱和溶液中,不能继续溶解该物质,但是可以继续溶解其他物质,故填:一定温度下,某物质的饱和溶液对于其它物质不一定是饱和的;
③a、由溶解度的概念可知,在常温下该物质的溶解度为40g;
b、D点表示的溶液为该温度的下的饱和溶液,溶质的质量分数为:$\frac{40g}{140g}$×100%≈28.6%;
c、A到B是向溶液中加入了20g的水,由B到C是向溶液中加入了20g溶质并使之完全溶解,故填:常温下,往A状态的溶液中加入20g溶质和20g水,使之充分溶解;
d、A和B中,溶质的质量相等,B中的溶剂多,所以浓度B<A;A是20g溶质溶解在80g水中,所得溶液液的溶质质量分数为:$\frac{20g}{20g+80g}$×100%=20%;C点表示的溶液为该温度的下的饱和溶液,溶质的质量分数为:$\frac{40g}{100g+40g}$×100%≈28.6%,所以A、B、C三个点表示溶液中溶质质量分数从大到小的关系是:C、A、B;
(3)溶液在生产和生活中的应用非常广泛,如生理盐水给病人补充水分.
故答案为:(1)①C;
②CaO+H2O═Ca(OH)2;
(2)①BD;
②a、减小;
b、一定温度下,某物质的饱和溶液对于其它物质不一定是饱和的;
③a、40;
b、28.6%;
c、常温下,往A状态的溶液中加入20 g溶质和20 g水,使之充分溶解;
d、C A B;
(3)生理盐水给病人补充水分.
点评 本题难度不大,主要考查了固体溶解度曲线的意义及根据固体的溶解度曲线解决相关的问题.


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 使用脱硫煤 | |
| B. | 加大城市绿化、道路定期洒水、控制工地扬沙 | |
| C. | 积极推行油品的升级 | |
| D. | 通过加高烟囱排放工业废气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 2016年3月5日,国务院总理李克强在2016年《政府工作报告》中指出,加强重大基础设施建设,到2020年高铁营业里程达到3万公里.而截至2015年底,国内高铁营运里程已经达到1.9万公里,也就是说需要在未来五年内新增1.1万公里.使人们的出行进入“高铁时代”.
2016年3月5日,国务院总理李克强在2016年《政府工作报告》中指出,加强重大基础设施建设,到2020年高铁营业里程达到3万公里.而截至2015年底,国内高铁营运里程已经达到1.9万公里,也就是说需要在未来五年内新增1.1万公里.使人们的出行进入“高铁时代”.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com