


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
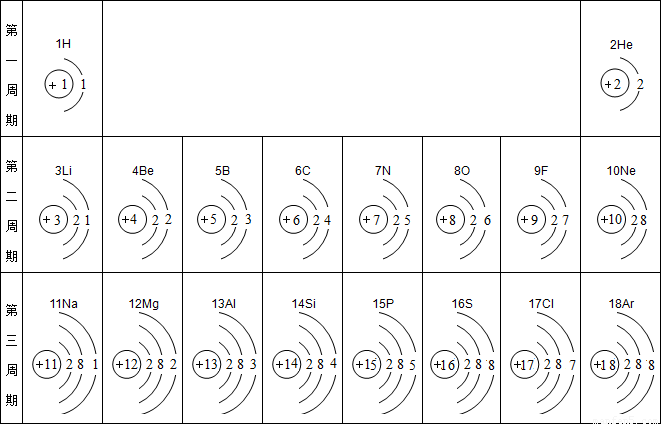
| 第1周期 | 1H 1.008 |
2He 4.003 | ||||||
| 第2周期 | 3Li 6.941 |
4Be 9.012 |
5B 10.81 |
6C 12.01 |
7N 14.01 |
8O 16.00 |
9F 19.00 |
10Ne 20.18 |
| 第3周期 | 11Na 22.99 |
12Mg 24.31 |
13Al 26.98 |
14Si 28.09 |
15P 30.97 |
16S 32.06 |
17Cl 35.45 |
18Ar 39.95 |
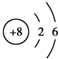 ,第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为
,第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为 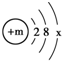 ,则x=
,则x=查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com