B
分析:根据铁与盐酸反应的化学方程式可以计算出24g纯镁能生成2g氢气.由于2g<2.15g,说明不纯的镁中所含的杂质能与盐酸反应且能产生氢气,而且等质量的镁和所含杂质相比,杂质与盐酸反应产生的氢气多.
解答:由于钠、镁、锌、铝、铁的相对原子质量由小到大的顺序是:钠<镁<铝<铁<锌,
因此等质量的镁、锌、铁与盐酸反应时产生的氢气质量由多到少的顺序是:铝>镁>铁>锌.把不纯的镁看作纯二价金属M,设其相对原子质量为X,则
M+H
2SO
4═MSO
4+H
2↑
X 2
24g 2.15g
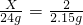
,
解得X═22.3
即组成金属的相对原子质量一定是一个比22.3大,一个小于22.3.由于镁的相对原子质量为24,所以另一金属的应该是相对原子质量小于24.且一定能够和酸反应得到氢气.
A中锌的相对原子质量为65,大于24,故A不符合题意.
B中铝的相对原子质量为27,但生成2g氢气只需18g铝即可,故B符合题意.
C中铁的相对原子质量为56,大于24,故C不符合题意.
D中钠的相对原子质量为23,但生成2g氢气只需46g钠,大于24,故D不符合题意.
故选B.
点评:本题考查不纯物质的成分,利用平均值法是解答本题的关键,学生应熟悉金属与酸的反应,将不纯物质的质量按照纯物质来计算,利用平均相对原子质量来确定铁中混有的金属.

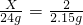 ,
,

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案