
| 猜想 | 实验操作 | 实验现象 | 结论(或化学方程式) |
| 猜想一:Na2CO3溶液显碱性 | 取少量Na2CO3溶液于试管中,滴入2-3滴酚酞试液,振荡 | 溶液变红色 | 溶液显碱性 |
| 猜想二:能与盐酸反应 | 取少量溶液于试管中, 然后滴加稀盐酸 | 有大量气泡产生 | 化学方程式 Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
| 猜想三:能与Ca(OH)2反应 | 向盛有少量Na2CO3溶液于试管中,滴加澄清石灰水 | 产生白色沉淀 | 化学方程式 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ |
| 猜想四:能与BaCl2反应 | 取少量Na2CO3溶液于试管中,滴入BaCl2溶液 | 产生白色沉淀 | 化学方程式Na2CO3+BaCl2═BaCO3↓+2NaCl 反应的基本类型为复分解反应 |
分析 根据碳酸钠的化学性质分析解答:水溶液呈碱性,能使酚酞变红,能与酸、某些碱、某些盐发生复分解反应,并根据反应写出有关反应的化学方程式,判断反应类型.
解答 解:碳酸钠是由金属离子和酸根离子构成的盐,水溶液显碱性,从而说明了能使无色酚酞变红的不一定是碱溶液;故答案为:盐;碱;不一定;
碳酸钠的水溶液呈碱性,能使酚酞试液变红,碳酸钠与盐酸反应生成氯化钠、二氧化碳和水,碳酸钠与氢氧化钙发生复分解反应生成碳酸钙白色沉淀,同时生成氢氧化钠,能与氯化钡反应生成碳酸钡沉淀和氯化钠,故答案为:
| 猜想 | 实验操作 | 实验现象 | 结论(或化学方程式) |
| 溶液变红色 | |||
| 取少量溶液于试管中,然后滴加稀盐酸 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | ||
| Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ | |||
| 产生白色沉淀 | Na2CO3+BaCl2═BaCO3↓+2NaCl;复分解反应 |
点评 本题重点考查了碳酸钠的化学性质,完成此题,要根据已有知识进行实验报告内容的补充,尤其是方程式的书写,因此同学们要注意平时对知识的积累,加强常见物质性质的记忆,尤其是物质的化学性质.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.07 | 17 Cl 氯 35.45 |
| A. | 失电子能力:Na>Al | B. | 镁和硅两种元素均属于非金属元素 | ||
| C. | 磷的相对原子质量是30.97 | D. | 得电子能力:S<Cl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 将一定量的生石灰加入一只洁净的烧杯中,加入碳酸钠溶液,充分反应后冷却到室温,通过过滤、洗涤、干燥得到固体A和溶液B,请回答以下问题.
将一定量的生石灰加入一只洁净的烧杯中,加入碳酸钠溶液,充分反应后冷却到室温,通过过滤、洗涤、干燥得到固体A和溶液B,请回答以下问题.| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| NaOH的溶解度 | 42 | 109 | 129 | 174 | 314 | 347 |
| Ca(OH)2的溶解度 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 |
| 实验步骤 | 实验现象 | 实验结论 |
| 甲同学:用一支洁净的试管取少量固体A,再加入过量稀盐酸. | 有气泡产生 | 猜想 正确 |
| 乙同学:用一支洁净的试管取少量固体A,加水,充分振荡,向上层清液中滴加酚酞试液. | 上层清液由无色变为红色 | 猜想 正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
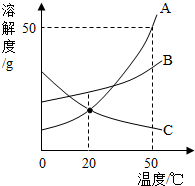 如图是A、B、C三种固体物质的溶解度曲线,下列分析不正确的是( )
如图是A、B、C三种固体物质的溶解度曲线,下列分析不正确的是( )| A. | 50℃时,三种物质的溶解度由大到小的顺序是A>B>C | |
| B. | 50℃时,把50g A放入50g水中形成75g A的饱和溶液 | |
| C. | 20℃时,A和C两种物质的溶解度相等 | |
| D. | 分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是B>C=A |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com