
【题目】一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁(黑色)、铁。
实验一:某化学兴趣小组的同学设计了如图1所示的实验装置测定某赤铁矿样品中Fe2O3的质量分数。
他们称取10.0g赤铁矿,当赤钛矿中的Fe2O3全部还原为Fe时,剩余固体在CO的保护下冷却、称量,质量为7.6g(假设赤铁矿中的杂质均不与CO反应)。
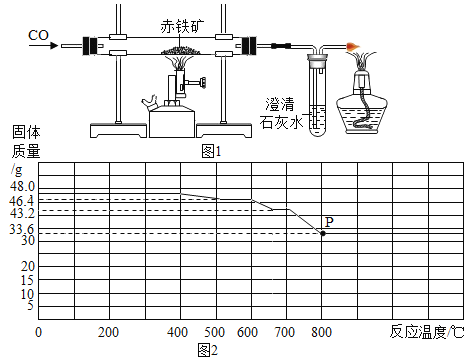
(1)实验过程中可观察到的现象是_____;
(2)实验结束时继续通入一氧化碳的目的是_____;
(3)该赤铁矿中Fe2O3的质量分数为______;
实验二:在钢铁厂的实验室,同学们采集了用某种热分析仪记录的CO与Fe2O3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线,如图2所示:
(4)根据图象分析写出P点时固体成分的化学式_____;
(5)固体质量由48.0g变为46.4g的过程中发生反应的化学方程式为_____。
【答案】红色粉末变为黑色,澄清石灰水变浑浊 防止生成的铁被空气中的氧气氧化 80% Fe 3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】
(1)一氧化碳和氧化铁反应生成铁和二氧化碳,所以图中玻璃管处实验现象是红色粉末变为黑色,二氧化碳能使澄清石灰水变浑浊,试管处实验现象是澄清石灰水变浑浊.故填:红色粉末变为黑色,澄清石灰水变浑浊;
(2)实验结束后继续通入一氧化碳到玻璃管冷却,目的是防止生成的铁被空气中的氧气氧化;故填:防止生成的铁被空气中的氧气氧化;
(3)设该赤铁矿中Fe2O3的质量为x

x=8g
该赤铁矿中Fe2O3的质量分数为![]() ×100%=80%;故填:80%;
×100%=80%;故填:80%;
(4)氧化铁中氧元素质量为![]() ,铁元素质量=48-14.4g=33.6g,,根据图象曲线可知,加热到800℃时三种氧化物反应完全,此时固体为Fe。故填:Fe;
,铁元素质量=48-14.4g=33.6g,,根据图象曲线可知,加热到800℃时三种氧化物反应完全,此时固体为Fe。故填:Fe;
(5)固体质量由48.0g变为46.4g时,对应温度为400-500℃,此时Fe2O3与CO反应,失去氧元素的质量为48g-46.4=1.6g,氧化铁中氧元素质量为![]() ,铁元素质量=48-14.4g=33.6g,残余固体中氧元素质量=14.4g-1.6g=12.8g,铁、氧原子个数比=
,铁元素质量=48-14.4g=33.6g,残余固体中氧元素质量=14.4g-1.6g=12.8g,铁、氧原子个数比=![]() =3:4,所以此时还原产物为Fe3O4。对应方程式为3Fe2O3+CO
=3:4,所以此时还原产物为Fe3O4。对应方程式为3Fe2O3+CO![]() 2Fe3O4+CO2。
2Fe3O4+CO2。
故填:3Fe2O3+CO![]() 2Fe3O4+CO2。
2Fe3O4+CO2。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:初中化学 来源: 题型:
【题目】地球大气中存在氧气(O2)和臭氧(O3)两种含氧元素的单质,其中臭氧氧主要存在于15000-30000米的高空,能减弱高能量紫外线对地球表面的辐射。
(1)O3表示一个_____________(填“原子”、“分子”或“离子”)
(2)高空中可发生转化:  ,该变化属于_______(填“物理”或“化学”)变化。
,该变化属于_______(填“物理”或“化学”)变化。
(3)镁在氧气中燃烧的化学方程式是____________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有趣的“纳米小人”是一系列结构式与人体相似的有机分子(化学式C39H42O2),是由莱斯大学的詹姆斯·托尔等人设计并合成分子,用于对年轻学生的化学教育,下列关于它的说法中正确的是( )
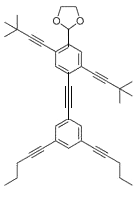
A.“纳米小人”中碳元素的质量分数约为86.3%
B.“纳米小人”是由碳、氢两个元素组成的
C.“纳米小人”中氢、氧元素的质量比为21:1
D.“纳米小人”的相对分子质量为532
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据图所示信息进行计算.
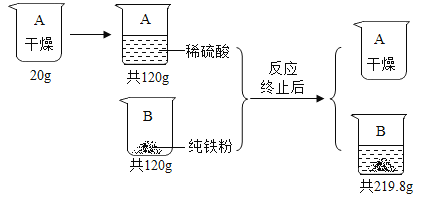
假设:稀硫酸转移完全且生成气体全部逸出.
(1)生成H2的质量为 。
(2)反应后的溶液中溶质质量分数为多少 ?(写出解题过程,最后结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验中常用仪器装置,请回答下列问题:
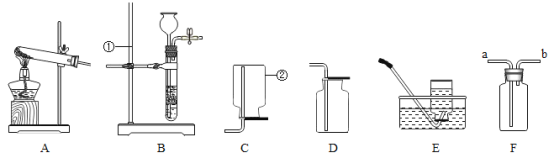
(1)指出带有标号的仪器名称:②____________。
(2)实验室用氯酸钾和二氧化锰混合加热制取氧气,应选用的发生装置是___________(填字母),化学方程式是______________。
(3)若实验室制取二氧化碳气体,应选用的收集装置是_____________(填字母,从“A到E中选择”)检验二氧化碳气体收集满的方法是______________。
(4)若用F装置除去一氧化碳气体中混有的二氧化碳气体,瓶中应盛放的试剂是__________(用化学式填写),气体应从____________(填“a”或“b”)端导管导入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KOH和NaOH的化学性质相似的原因是____,请写出 KOH与二氧化碳反应的化学方程式______,请用两种不同类别的试剂证明二者确实发生了化学反应,这两种试剂分别是_________、_________,
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50 g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如图所示。(结果保留两位小数)
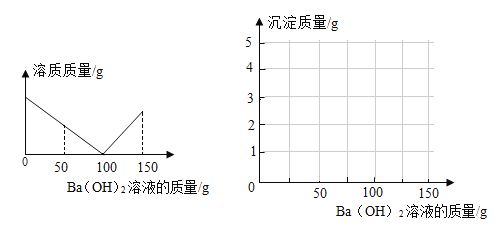
(1)参加反应的Ba(OH)2质量共有 g。当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH 7(填“>”“<”或“=”)。
(2)求该硫酸溶液的溶质质量分数。
(3)通过计算,在图中画出产生沉淀质量与滴加Ba(OH)2溶液的质量关系。
(4)滴加Ba(OH)2溶液至150g时,所得溶液的溶质质量分数 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中错误的是( )
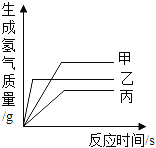
A. 金属活动性:乙>甲>丙 B. 生成氢气的质量:甲>乙>丙
C. 相对原子质量:乙>丙>甲 D. 消耗硫酸的质量:甲>乙>丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com