
分析 根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算铁的质量.
解答 解:根据质量守恒定律可得,生成的氢气的质量为11.4g+50.0g+100.0g-161.0g=0.4g
设参加反应的铁的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x 0.4g
$\frac{56}{2}$=$\frac{x}{0.4g}$
x=11.2g
该铁合金中铁的质量分数为$\frac{11.2g}{11.4g}$×100%≈98.2%
答:(1)反应产生的氢气的质量为0.4g
(2)该铁合金中铁的质量分数为98.2%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:实验探究题
 气体的制取和收集是初中化学的核心知识.小组同学在实验室进行气体制取的探究,请你一同参与:
气体的制取和收集是初中化学的核心知识.小组同学在实验室进行气体制取的探究,请你一同参与:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在溶液中K+和SO42-能大量共存 | |
| B. | 氯化钠是由氯化钠分子构成的 | |
| C. | 最外层电子数决定了元素的化学性质 | |
| D. | 木炭还原氧化铜反应中,氧化铜是氧化剂,木炭是还原剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
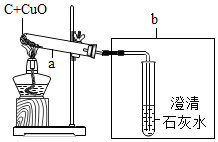 某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图.实验时,a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀.
某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图.实验时,a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀.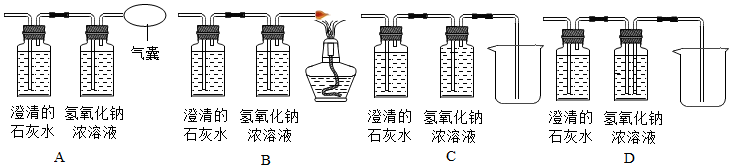
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com