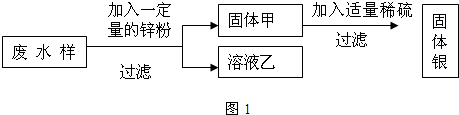
解答:解:某研究性学习小组在综合实践活动中对某化工厂化验室排除的废水感兴趣,并对其进行了探究:
(1)由于锌在铁和银的前面,因此无论和谁反应都会有硝酸锌生成,故答案为:Zn(NO
3)
2,Zn(NO
3)
2、AgNO
3(2)由于第一组同学研究的是无色溶液,即溶液中没有硝酸亚铁,说明硝酸亚铁中的铁元素已经全部转化成了金属铁,即在滤渣中一定有金属铁;而在过滤前,铁又能和溶液中的硝酸银反应,因此有铁就不可能有硝酸银,故答案为:若猜想2成立,说明Fe(NO
3)
2与Zn反应生成Fe,而Fe会与过滤前的溶液中AgNO
3反应,即铁和AgNO
3不可能都有,从而排除猜想2;
(3)由于第二组研究的是浅绿色溶液,即溶液中一定含有硝酸亚铁,但溶液中除了含有硝酸亚铁外,还一定会含有新生成的硝酸锌,因此只要证明是否含有硝酸银即可,可以选择一种只能够和硝酸银溶液反应而且有明显实验现象的物质就行.故答案为:
| 实验操作 | 实验现象和结论 |
在溶液中插入一根铜丝;或
滴加几滴稀盐酸(或其他氯化物溶液) | 铜丝表面无变化,Zn(NO3)2、Fe(NO3)3,铜丝表面有银白色固体析出,Zn(NO3)2、Fe(NO3)2、AgNO3
;或溶液无明显变化,Zn(NO3)2、Fe(NO3)2,溶液中有沉淀生成,Zn(NO3)2、Fe(NO3)2、AgNO3 |
(4)根据上述分析可得,溶液为无色溶液时,溶液中只有硝酸锌;溶液为浅绿色溶液时,溶液中有硝酸亚铁和硝酸锌;在金属活动性顺序中,最活泼的金属首先和那种和它隔着远的金属的盐溶液反应,故答案为:Zn(NO
3)
2,Zn(NO
3)
2,Fe(NO
3)
2,AgNO
3,Fe(NO
3)
2(5)由于加入过量的锌虽然把银全部置换出来了,但是置换出来的金属银中还混有金属铁和锌,为了得到纯净的银,还得消耗大量的稀硫酸,而且生成的硫酸亚铁和硫酸锌也会对环境造成一定的污染,故答案为:浪费一些锌和稀硫酸,最好能对亚铁盐和锌盐进行回收利用,又能减少污染(或其他合理答案)
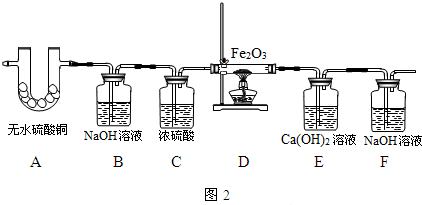
某课外活动小组的同学对天然气燃烧后采集的气体样品中是否含有CO(假设该样品中不含除CO之外的其它能与Fe
2O
3反应的物质)和水蒸气进行探究:
(1)收集爆炸现场的气体样品时,可用气球收集或用盛满水的集气瓶在现场把水倒掉的方法收集.
(2)能确认气体样品中含有CO的现象是D中黑色粉末变红,E中石灰水变浑浊,装置E中反应的方程式是CO
2+Ca(OH)
2═CaCO
3↓+H
2O.
(3)实验小组的目的是检验现场的气体中是否含有CO和水蒸气,首先要检验水蒸气,检验水蒸气用无水硫酸铜,检验一氧化碳要根据它还原氧化铁是否生成二氧化碳,故连接顺序是先通过无水硫酸铜检验水的存在,然后用氢氧化钠溶液除去二氧化碳,用浓硫酸干燥气体,通过灼热的氧化铁,把生成的气体通过澄清石灰水,进行检验.
(4)D中反应现象红色粉末变为黑色粉末,一氧化碳与氧化铁在高温下反应生成二氧化碳和铁,其反应方程式为:3CO+Fe
2O
3 2Fe+3CO
2(5)反应后测得装置E质量增重1.1g,即二氧化碳的质量是1.1g,然后根据二氧化碳的质量求CO的质量.
设氧化铁的质量分数为x
3CO+Fe
2O
3 2Fe+3CO
2 3×28 3×44
x 1.1g
则
=,解得x=0.7g.
因为一氧化碳有毒,从环境保护的角度考虑,要对尾气进行处理.故在F出口处将气体收集或点燃.
故答案为:
【讨论分析】(1)第二组:Zn(NO
3)
2; Zn(NO
3)
2 AgNO
3.
(2)若猜想2成立,说明Fe(NO
3)
2与Zn反应生成Fe,而Fe会与过滤前的溶液中AgNO
3反应,即铁和AgNO
3不可能都有,从而排除猜想2;
(3)
| 试验操作 | 试验结论和现象 |
| 取少量乙溶液于试管中,观察 | 若铜丝表面无变化 则是 Zn(NO3)2、Fe(NO3)3,若铜丝表面有银白色固体析出则是 Zn(NO3)2、Fe(NO3)2、AgNO3. |
【交流后得出结论】
(4)Zn(NO
3)
2,Zn(NO
3)
2和 Fe(NO
3)
2; AgNO
3,Fe(NO
3)
2.
【探究后反思】
(5)浪费一些锌和稀硫酸,最好能对亚铁盐和锌盐进行回收利用,又能减少污染
[问题]
(1)可用气球收集或用盛满水的集气瓶在现场把水倒掉的方法收集.
(2)D中红色粉末变为黑色粉末,E中石灰水变浑浊.
(3)除去气体中二氧化碳的干扰,干燥吸水,检验是否有二氧化碳生成.
(4)红色粉末变为黑色粉末,3CO+Fe
2O
32Fe+3CO
2.
(5)0.7g;装置漏气,一氧化碳有毒,从环境保护的角度考虑,要对尾气进行处理,在F出口处将气体收集或点燃.



 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案