
相同质量的下列物质①Zn②ZnO③Zn(OH)2④ZnCO3,分别跟质量分数都相同且适量的稀盐酸充分反应,所得溶液的溶质质量分数的关系正确的是 ( )
| A.①>②>③>④ | B.④>③>②>① |
| C.①>②=④>③ | D.④>①>②=③ |
C
解析试题分析:分析四个反应原理可以发现生成物都是氯化钙溶液,题中所给物质与等质量、等质量分数的稀盐酸反应,根据氯元素的质量守恒可知反应后生成的氯化锌的质量相等;要比较所得溶液中ZnCl2的质量分数大小,根据溶质质量分数= 可知,只需判断反应后的溶液的质量的大小即可;
可知,只需判断反应后的溶液的质量的大小即可;
由于盐酸是等质量的,故只需计算实际增加的量即可;①Zn+2HCl═ZnCl2+H2↑ 实际增加质量;
②ZnO+2HCl═ZnCl2+H2O 实际增加质量;
65 2 65-2=63 81 81
③Zn(OH)2+2HCl═ZnCl2+2H2O 实际增加质量; ④ZnCO3+2HCl═ZnCl2+H2O+CO2↑ 实际增加质量;
99 99 125 44 125-44=81
由此可知,③的溶液质量最大,故质量分数最小;②④的溶液质量相等,故质量分数也相等;①的溶液质量最小,故质量分数最大,即溶液中溶质的质量分数的大小顺序为:①>②=④>③;故选C
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:初中化学 来源: 题型:计算题
定量的数据分析,可以使你的分析更加准确。某高钙片(见图)的使用说明书部分内容如下: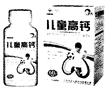
【配料】碳酸钙( CaCO3)、甘露醇、乳糖、淀粉、维生素D。
【规格】2.5g/片,每片中含钙0.5 g。
【食用方法】每日1次,每次1片,嚼食。
(1)碳酸钙( CaCO3)的相对分子质量为 ;
碳酸钙中各元素的质量比为 。
(2)若此高钙片中所含钙元素都来自碳酸钙,试计算一片该高钙片中所含碳酸钙的质量分数?(含计算过程)
(3)葡萄糖酸钙的化学式为Ca( C6 H11O7)2,其相对分子质量为430。某葡萄糖酸钙保健品每片含葡萄糖酸钙0.5 g,1片高钙片所含钙元素的质量约相当于_______片(计算结果取整数)该葡萄糖酸钙保健品所含钙元素的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
在反应3X+4Y=2Z中,已知X的相对分子质量是32,Z的相对分子质量是102,则Y的相对分子质量为
| A.27 | B.70 | C.108 | D.1 72 |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
甲和乙反应可制备燃料丙,其微观示意图如下.下列说法错误的是( )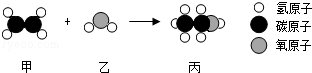
| A.该反应属于化合反应 | B.该反应中分子和原子的种类都发生了改变 |
| C.甲、丙是有机物,乙是氧化物 | D.甲、丙分别在氧气中完全燃烧,产物相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
工业上以CaO和HNO3为原料制备Ca(NO3)2?6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为
| A.41.2% | B.53.8% | C.58.3% | D.70.0% |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
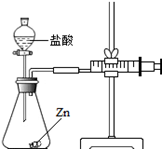
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分) “黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,进行实验。取10 g样品加入50 g稀硫酸中,恰好完全反应,称量剩余物为59.9g。
求:(1)产生氢气的质量 。
(2)计算黄铜样品中铜的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
已知某反映的微观示意图如下,下列说法正确的是( )
| A.该反应不符合质量守恒定律 | B.参加反应的分子个数比是5:2 |
| C.该反应中反应物都是化合物 | D.该反应前后的分子种类改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com