
 ×100%求稀盐酸中HCl的质量分数和滤液中溶质的质量分数.
×100%求稀盐酸中HCl的质量分数和滤液中溶质的质量分数.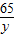 =
=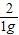
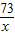 =
=
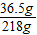 ×100%=16.7%
×100%=16.7%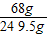 100%=27.3%
100%=27.3% ×100%是解题的关键.
×100%是解题的关键. 

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
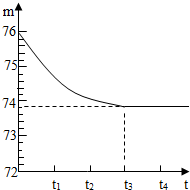 (2005?山东)我省各地都有丰富的石灰石矿产资源.有一矿山上的石灰石样品,其中只含杂质二氧化硅(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).小琳和他的同学想测定该样品中碳酸钙的质量分数,他们取一块石灰石样品,将其粉碎后,称出6g放入烧杯内(烧杯的质量为20g),然后加入50g足量稀盐酸,用玻璃棒搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质的总质量(m)的关系如图所示.
(2005?山东)我省各地都有丰富的石灰石矿产资源.有一矿山上的石灰石样品,其中只含杂质二氧化硅(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体).小琳和他的同学想测定该样品中碳酸钙的质量分数,他们取一块石灰石样品,将其粉碎后,称出6g放入烧杯内(烧杯的质量为20g),然后加入50g足量稀盐酸,用玻璃棒搅拌至不再产生气泡为止.反应所需时间(t)和烧杯及其所盛物质的总质量(m)的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com