
分析 根据题意,由于锌与硫酸反应放出氢气而使锌完全反应前后物质的总质量有所减小,减小的质量即放出氢气的质量,运用质量守恒定律,求出氢气质量;然后由氢气质量,根据反应的化学方程式,计算出含杂质的锌粒中金属锌的质量即可求得含杂质的锌粒中金属锌的质量分数.
解答 解:(1)根据质量守恒定律,反应中生成氢气的质量=20g+200g-219.4g=0.6g;
(2)设含杂质的锌粒中金属锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.6g
$\frac{65}{x}=\frac{2}{0.6g}$
x=19.5g
这20g含杂质的锌粒中金属锌的质量分数=$\frac{19.5g}{20g}×$100%=97.5%
答案:
(1)反应后生成氢气的质量为0.6g;
(2)此20g含杂质的锌粒中金属锌的质量分数为97.5%.
点评 利用质量守恒定律求出反应放出氢气的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
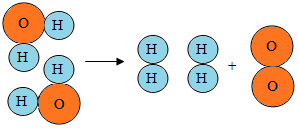 水是重要的自然资源.
水是重要的自然资源.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com