
| 实验序号 | 实验温度/℃ | 催化剂 | 5%H2O2溶液体积/mL | 实验现象 |
| (1) | 20 | 无 | 10 | 无明显现象 |
| (2) | 50 | 无 | 10 | 有气泡产生 |
| (3) | 20 | 1gCuCl2 | 10 | 有气泡产生 |
| (4) | 20 | 1gFeCl3 | 10 | 有气泡产生(快慢与(3)不同) |
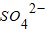 对此反应无催化作用)
对此反应无催化作用) 2H2O+O2↑;
2H2O+O2↑; 2H2O+O2↑;
2H2O+O2↑;

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:阅读理解
| 实验序号 | 实验温度/℃ | 催化剂 | 5%H2O2溶液体积/mL | 实验现象 |
| (1) | 20 | 无 | 10 | 无明显现象 |
| (2) | 50 | 无 | 10 | 有气泡产生 |
| (3) | 20 | 1gCuCl2 | 10 | 有气泡产生 |
| (4) | 20 | 1gFeCl3 | 10 | 有气泡产生(快慢与(3)不同) |
| ||
| ||
| 提出假设 | 除H2O2外至少还需选用的试剂 |
| 假设1:只有Fe3+有催化作用 | ① 硫酸铁 硫酸铁 |
| 假设2:只有Cl--有催化作用 | ② 氯化钠 氯化钠 |
| 假设3:Fe3+和Cl-都有催化作用 | ③ 氯化铁 氯化铁 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 浓度 时间(秒) 反应条件 |
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2无催化剂、加热 | 10 | 25 | 60 | 120 |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
查看答案和解析>>
科目:初中化学 来源:黑龙江省中考真题 题型:实验题

查看答案和解析>>
科目:初中化学 来源: 题型:
某课外学习小组对过氧化氢的分解反应进行探究,实验条件及产生的现象见下表:
| 实验序号 | 实验温度/0C | 催化剂 | 5%H2O2溶液体积/mL | 实验现象 |
| (1) | 20 | 无 | 10 | 无明显现象 |
| (2) | 50 | 无 | 10 | 有气泡产生 |
| (3) | 20 | 1gCuCl2 | 10 | 有气泡产生 |
| (4) | 20 | 1gFeCl3 | 10 | 有气泡产生[快慢与(3)不同] |
(资料显示Na+、SO42-对此反应无催化作用)根据以上信息回答下列问题:
(1)写出实验(4)的化学方程式 ;
(2)实验(1)与(2)的目的是探究 ;
(3)实验(3)与(4)的目的是探究 ;
(4)为了进一步探究FeCl3在溶液中起催化作用的是什么离子,还应进一步设计实验,请根据提出的假设填写所需试剂;
| 提出假设 | 除H2O2外至少还需选用的试剂 |
| 假设l:只有Fe3+有催化作用 | ① |
| 假设2:只有Cl-有催化作用 | ② |
| 假设3:Fe3+ 、Cl一都有催化作用 | ③ |

(5)为了证明FeCl3是该反应的催化剂,还需:
①验证FeCl3在反应前后质量不变;
②验证 。
(6)小明用H2O2和MnO2按右图装置制取少量的O2,其中小试管的作用是
。(填2种即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com