
| A. | SO42-、Cl-、Na+、H+ | B. | K+、SO42-、Cu2+、NO3- | ||
| C. | Cl-、K+、SO42-、Na+ | D. | Ca2+、Na+、CO32-、Cl- |
分析 pH为13的水溶液显碱性,水溶液中含有大量的OH-;根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能大量共存,据此进行分析判断即可.
解答 解:pH为13的水溶液显碱性,水溶液中含有大量的OH-.
A、H+和OH-结合生成水,不能大量共存,故选项错误.
B、Cu2+与溶液中的OH-结合生成氢氧化铜沉淀,不能大量共存,故选项错误.
C、四种离子间之间不能结合成沉淀、气体或水,能在碱性溶液中共存,故选项正确.
D、Ca2+、CO32-在溶液中结合生成碳酸钙沉淀,不能大量共存,故选项错误.
故选:C.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | a>b>c | B. | b<a,b<c | C. | b>a,b>c | D. | a<b<c |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入足量氯化钙溶液 | 产生白色沉淀 | 溶液只有部分 |
| ②取少量充分反应后的溶液于试管中,滴入酚酞试液 | 酚酞试液变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 碳及碳的化合物在人类生产生活中应用广泛,随着科技的发展,含碳元素的新材料不断涌现.请根据所学知识回答下列问题:
碳及碳的化合物在人类生产生活中应用广泛,随着科技的发展,含碳元素的新材料不断涌现.请根据所学知识回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Cu$\stackrel{+HCl}{→}$CuCl2$\stackrel{+KOH}{→}$Cu(OH)2 | |
| B. | Cu$\stackrel{+O_{2}}{→}$CuO$\stackrel{+H_{2}SO_{4}}{→}$CuSO4$\stackrel{+NaOH}{→}$Cu(OH)2 | |
| C. | Cu$\stackrel{+O_{2}}{→}$CuO$\stackrel{+H_{2}SO_{4}}{→}$CuSO4$\stackrel{+Ba(OH)_{2}}{→}$Cu(OH)2 | |
| D. | Cu$\stackrel{+H_{2}SO_{4}(浓)}{→}$CuSO4$\stackrel{+NaOH}{→}$Cu(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
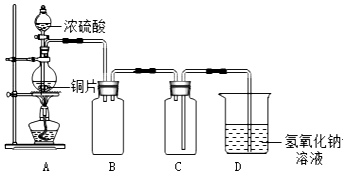

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 20 克 | B. | 25 克 | C. | 30 克 | D. | 40 克 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
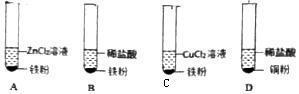
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com