将NaCl和Na2CO3的固体混合物31.5g溶于99.9g水中,滴入73.0g10%的稀盐酸,恰好完全反应.反应的化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O.请计算:
(1)原稀盐酸中含溶质HCl的质量.
(2)所得溶液中溶质的质量分数为多少?
【答案】
分析:(1)依据溶液的质量与溶质的质量分数的乘积即为溶质的质量求解即可;
(2)依据生成的氯化钠质量和原混合物中氯化钠的质量求出溶液中溶质的质量,而后利用反应前物质的质量与生成的二氧化碳质量之差求出所得溶液的质量,即可求溶液的质量分数;
解答:解:(1)73.0g10%的稀盐酸中氯化氢的质量是73.0g×10%=7.3g;
(2)设碳酸钠与盐酸反应时生成的氯化钠质量是x,生成二氧化碳的质量是y,碳酸钠的质量是z
Na
2CO
3+2HCl═2NaCl+CO
2↑+H
2O
106 73 117 44
z 7.3g x y
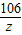
=

x=11.7g y=4.4g z=10.6g
则所得溶液之溶质的质量是11.7g+(31.5g-10.6g)=32.6g,所得溶液的质量为31.5g+99.9g+73.0g-4.4g=200g,所以所得溶液的质量分数为:
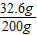
×100%=16.3%;
答:(1)原稀盐酸中含溶质HCl的质量是7.3g.
(2)所得溶液液中溶质的质量分数为16.3%;
点评:本题主要考查学生运用化学方程式进行计算,要分清溶液中的溶质既有原来的样品中的也有反应生成的然后根据碳酸钠和稀盐酸反应的化学方程式计算可得;

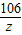 =
=
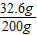 ×100%=16.3%;
×100%=16.3%;

 阅读快车系列答案
阅读快车系列答案