
菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究,取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了1.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
【答案】(1)4.4g
(2)解:设10g菱镁矿中碳酸镁的质量为x,实验中所硫酸的质量为y,生成硫酸镁的质量为z。
MgCO3+H2SO4=MgSO4+CO2↑+H2O
84 98 120  44
44
x y z 4.4g
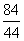 =
= 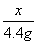
x= 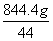 =8.4g
=8.4g
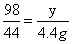 y=
y=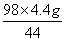 =9.8g
=9.8g
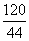 =
= 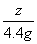 z=
z= 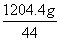 =12g
=12g
菱镁矿中镁元素的质量分数= 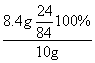 ×100%=24%
×100%=24%
(3)该实验研究中所用H2SO4溶液的溶质质量分数是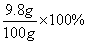 =9.8%
=9.8%
(4)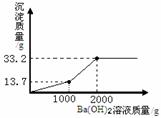
【解析】根据表格信息不难发现,10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为4.4g;要计算菱镁矿中镁的质量分数,需先根据碳酸镁与硫酸反应的化学方程式及二氧化碳的质量,计算出碳酸镁的质量,然后再结合碳酸镁中镁元素的质量分数计算出镁元素的质量最后表示出,碳酸镁中镁元素的质量分数即可;碳酸镁与硫酸反应的化学方程式及生成二氧化碳的质量,可计算出参加反应的硫酸的质量,再结合硫酸溶液的质量便可计算出所使用硫酸的溶质质量分数;实验中加入的硫酸的总质量为200g×9.8%=19.6g,与氢氧化钡反应的硫酸质量19.6g-9.8g=9.8g,根据H2SO4+Ba(OH)2=BaSO4↓+2H2O可计算出参加反应的氢氧钡溶液的质量为1000g,生成硫酸钡沉淀的质量为13.7g,根据参加反应的硫酸镁的质量及MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓可计算出参加反应的氢氧钡溶液的质量为1000g,反应生成硫酸钡沉淀的质量为13.7g,反应生成氢氧化镁沉淀的质量为5.8g。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:初中化学 来源: 题型:
维生素、糖类、油脂、蛋白质四类物质中,有关说法错误的是( )
A.都含有碳、氢、氧、氮四种元素
B.糖类习惯上可称为碳水化合物
C.都是人体需要的营养物 质
质
D.都属于有机物
查看答案和解析>>
科目:初中化学 来源: 题型:
为了节约林木资源,近几年兴起的石头纸,石头纸可用沿海水产养殖中产生的大量废弃贝壳制得。为了测定某种贝壳中碳酸钙的质量分数,取贝壳25g,加入200g的稀盐酸,恰好完全反应,称得反应后物质的总质量为 216.2g(假设贝壳中其他物质不与盐酸反应且不溶于水)。请你计算:
216.2g(假设贝壳中其他物质不与盐酸反应且不溶于水)。请你计算:
(1)贝壳中碳酸钙的质量分数;
(2)反应后所得溶液中溶质的质量分数(精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
课外探究小组对实验教师提供的一包白色固体(可能是NaCl、Na2SO4、Na2CO3和NaNO3的一种或几种)进行了下面的实验,且每步实验中均加入足量的试剂,至充分反应。实验过程、现象见下图:
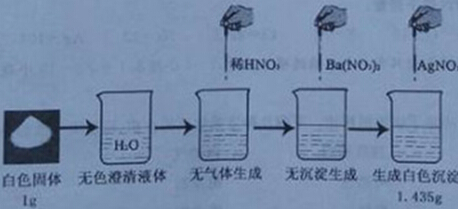
请分析实验过程并完成以下问题:
(1)实验中不能用稀盐酸代替稀硝酸的原因是 ;
(2)滴加Ba(NO3)2的目的是 ;
(3)通过计算推断:原白色固体的成分为 。(简单写出必要的计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室制取氧气时,某同学取质量为x的高锰酸钾加热,记录产生氧气的质量和时间的关系如图所示,请回答下列问题:

(1)t0--t1,t4---t5时段,固体的质量不发生变化,是为什么?
(2)请根据图中的数据,计算高锰酸钾的质量是多少?(写出计算的过程)
(3)请在坐标中,画出锰元素的质量在t0--t5时段的变化示意图。
查看答案和解析>>
科目:初中化学 来源: 题型:
将100g氯化钾样品(含有碳酸钾杂质)加入到50g盐酸中,样品完全反应,产生的气体全部逸出,得到145.6g溶液。请计算:
(1)产生气体的质量为 g;
(2)样品中氯化钾的质量分数(精确至0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
请根据下图所示的实验过程和提供的数据计算
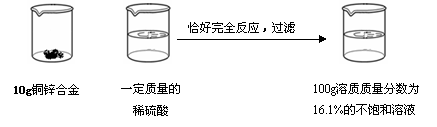 |
+
(1)生成氢气 g;
(2)合金中铜的质量分数是 ;
(3)所用稀硫酸的溶质质量分数是多少?(写出计算过程,计算结果保留到0 .1%)
.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
将氯化钠和碳酸钠的混合物33.8g放入125g稀盐酸中,恰恰好完全反应,得氯化钠溶液150g。计算:
(1)反应后生成的CO2质量是 。
(2)反应后所得溶液中溶质质量分数为多少?(要求有计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
某奶制品的营养成分见表。
某奶制品的营养成分表
| 项 目 | 每100 mL | NRV% |
| 能量 | 290 kJ | 3% |
| 蛋白质 | 3.2 g | 5% |
| 脂肪 | 4.0 g | 7% |
| 碳水化合物 | 4.8 g | 2% |
| 钠盐 | 62 mg | 3% |
(1)________和水也是人体必需的基本营养物质,但在表中未标示。
(2)该奶制品中________能够提供能量(任写一种)。
(3)奶制品中含有丰富的钙________(选填“单质”“原子”或“元素”),儿童每日要摄取足够量的钙,才能避免________(填字母序号)。
a.贫血症 b.佝偻病 c.甲状腺肿大
(4)下列物质不会使蛋白质失去原有生理活性的是________(填字母序号)。
a.浓硝酸 b.乙酸铅 c.硫酸铵 d.甲醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com